

Variación temporal del ensamblaje de mariposas asociadas a la Cuenca de la Calaboza, Yopal, Casanare, Colombia (Lepidoptera: Papilionoidea)
Temporal variation of the assemblages of butterflies associated with the La Calaboza, Yopal, Casanare, Colombia (Lepidoptera: Papilionoidea)
Variación temporal del ensamblaje de mariposas asociadas a la Cuenca de la Calaboza, Yopal, Casanare, Colombia (Lepidoptera: Papilionoidea)
SHILAP Revista de Lepidopterología, vol. 46, núm. 184, 2018
Sociedad Hispano-Luso-Americana de Lepidopterología
Recepción: 15 Abril 2018
Aprobación: 15 Mayo 2018
Publicación: 15 Diciembre 2018
Resumen: La variación estacional puede afectar tanto a la estructura del hábitat como a la disponibilidad de recursos, lo que puede generar diferentes respuestas de las especies animales como las mariposas. Por tal razón, se planteó evaluar el efecto de la variación temporal en el ensamblaje de mariposas en la cuenca de la Calaboza, Casanare, Colombia, teniendo dos épocas de muestreo: Bajas lluvias y altas lluvias y empleando métodos de recolecta activos y pasivos planteados para el estudio de mariposas. Se logró evidenciar una variación en la composición, abundancia y riqueza de mariposas a lo largo del muestreo, en donde la familia Nymphalidae presentó mayor diversidad tanto para la época de altas y bajas lluvias seguido de Pieridae. Por su parte, Lycaenidae y Riodinidae presentaron los menores valores de abundancia y riqueza en ambas épocas de muestreo. Se observó una variación en la composición de las especies de mariposas por época de muestreo, en donde Pyrgus orcus (Stoll, 1780), Memphis ambrosia (Druce, 1874), Eresia clara (Linnaeus, 1758), Cissia tiessa (Doubleday, 1848), Euptoieta claudia (Cramer, 1775), Taygetis rufomarginata (Staudinger, 1888), Aphrissa statira (Cramer, 1777), Melete polyhymnia (Felder & Felder, 1865) y Hypoleria ocalea (Doubleday, 1847), fueron exclusivas de época de bajas lluvias, mientras que Pyrgus oileus (Linnaeus, 1767), Eueides lybia (Fabricius, 1775), Itaballia demophile (Linnaeus, 1763), Dircenna dero (Hübner, 1823), Hamadryas arinome (Lucas, 1853), Taygetis andromeda (Butler, 1877), Eunica malvina (Bates, 1864), Posttaygetis penelea (Cramer, 1777), entre otras, fueron especies exclusivas de la época de Altas Lluvias. Se evidenció que especies como Historis acheronta (Fabricius, 1775) y Heliconius erato (Linnaeus, 1758) fueron co-dominantes, tanto para la época de bajas como de altas lluvias. Estos resultados, indican que a nivel de cuenca existen condiciones ecosistémicas que soportan los requerimientos biológicos para la supervivencia de la comunidad de mariposas, a pesar de la especificidad en la presencia de algunas especies por época climática, se reporta una alta diversidad de especies en el área de estudio importantes para el equilibrio ecosistémico, por lo que la Calaboza se convierte en un área de importancia para conservación a nivel de piedemonte en la región de la Orinoquia colombiana.
Palabras clave: Lepidoptera, Papilionoidea, Piedemonte, comunidad, diversidad, conservación, Colombia.
Abstract: Temporal variation can affect the structure of the habitat and the availability of resources, which can generate different responses of animal species such as butterflies. For this reason, we were proposed to evaluate the effect of the temporal variation in the assembly of butterflies in the Calaboza, Casanare, Colombia, having two sampling periods: Low Rains and High Rains and using active and passive collection methods proposed for the study of butterflies. It was possible to show a variation in the composition, abundance and richness of butterflies throughout the sampling, where the Nymphalidae family presented greater diversity for both the High and Low Rainy seasons followed by Pieridae family. On the other hand, Lycaenidae and Riodinidae presented the lowest values of abundance and wealth in both sampling seasons. A variation in the composition of the butterflies species was observed by sampling period, where Pyrgus orcus (Stoll, 1780), Memphis ambrosia (Druce, 1874), Eresia clara (Linnaeus, 1758), Cissia tiessa (Doubleday, 1848), Euptoieta claudia (Cramer, 1775), Taygetis rufomarginata (Staudinger, 1888), Aphrissa statira (Cramer, 1777), Melete polyhymnia (Felder & Felder, 1865) and Hypoleria ocalea (Doubleday, 1847), were exclusive of low rains period, while Pyrgus oileus (Linnaeus, 1767), Eueides lybia (Fabricius, 1775), Itaballia demophile (Linnaeus, 1763), Dircenna dero (Hübner, 1823), Hamadryas arinome (Lucas, 1853), Taygetis andromeda (Butler, 1877), Eunica malvina (Bates, 1864), Posttaygetis penelea (Cramer, 1777), among others, were exclusive species of the High Rainy season. We were evidenced that species such as Historis acheronta (Fabricius, 1775) and Heliconius erato (Linnaeus, 1758) were co-dominant for both the Low season and the High Rainy season. These results indicate that there are ecosystem conditions that support the biological requirements for the survival of the butterflies’ community, despite the specific nature of the presence of some species by climate season; a high diversity of species is reported. Important study area for the ecosystem equilibrium, so the Calaboza becomes an area of importance for conservation at piedmont level in the region of the Colombian Orinoquia.
Keywords: Lepidoptera, Papilionoidea, Piedmont, community, diversity, conservation, Colombia.
Temporal variation of the assemblages of butterflies associated with the La Calaboza, Yopal, Casanare, Colombia (Lepidoptera: Papilionoidea)
Introducción
En el Neotrópico, Colombia es considerado uno de los países más megadiversos con una gran variedad de especies tanto de animales como de vegetales (ANDRADE-C., 2011; URBANO et al., 2014; MAHECHA-J. & DÍAZ-S., 2015). No obstante, esta biodiversidad está siendo amenazada constantemente por los altos niveles de deforestación dado los crecientes eventos de transformación de los ecosistemas naturales (VAN DERHAMMEN & ANDRADE, 2003; RUDAS et al., 2007; MAHECHA-JIMÉNEZ et al., 2011; URBANO et al., 2014).
Los eventos de transformación están relacionados a procesos de colonización y ampliación de la frontera agrícola, minera y ganadera (SANTOS & TELLERIA, 2006; URBANO et al., 2014). Estos procesos han contribuido a la perdida de alrededor del 40% de la cobertura original del país, en donde la región andina ha sido la más afectada en términos de pérdida de biodiversidad en todos sus niveles: Riqueza de Especies, Ecosistémico y Genético (ANDRADE-C., 2011; URBANO et al., 2014). En este orden de ideas, la intrusión de especies foráneas o exóticas y la sobre-explotación de los recursos naturales han contribuido en gran parte a la pérdida de diversidad biológica en varias regiones geográficas de Colombia (BAPTISTE et al., 2010), en espacial ocasionando la pérdida de especies endémicas y la disminución de grupos taxonómicos sensibles a cambios ambientales, como los son los Lepidoptera (MAHECHA- JIMÉNEZ et al., 2011; TINAJERO & RODRÍGUEZ-ESTRELLA, 2012; URBANO et al., 2014;).
En el Neotrópico, Colombia es considerado uno de los países más megadiversos con una gran variedad de especies tanto de animales como de vegetales (ANDRADE-C., 2011; URBANO et al., 2014; MAHECHA-J. & DÍAZ-S., 2015). No obstante, esta biodiversidad está siendo amenazada constantemente por los altos niveles de deforestación dado los crecientes eventos de transformación de los ecosistemas naturales (VAN DERHAMMEN & ANDRADE, 2003; RUDAS et al., 2007; MAHECHA-JIMÉNEZ et al., 2011; URBANO et al., 2014).
Los eventos de transformación están relacionados a procesos de colonización y ampliación de la frontera agrícola, minera y ganadera (SANTOS & TELLERIA, 2006; URBANO et al., 2014). Estos procesos han contribuido a la perdida de alrededor del 40% de la cobertura original del país, en donde la región andina ha sido la más afectada en términos de pérdida de biodiversidad en todos sus niveles: Riqueza de Especies, Ecosistémico y Genético (ANDRADE-C., 2011; URBANO et al., 2014). En este orden de ideas, la intrusión de especies foráneas o exóticas y la sobre-explotación de los recursos naturales han contribuido en gran parte a la pérdida de diversidad biológica en varias regiones geográficas de Colombia (BAPTISTE et al., 2010), en espacial ocasionando la pérdida de especies endémicas y la disminución de grupos taxonómicos sensibles a cambios ambientales, como los son los Lepidoptera (MAHECHA- JIMÉNEZ et al., 2011; TINAJERO & RODRÍGUEZ-ESTRELLA, 2012; URBANO et al., 2014;).
Estudios han demostrado que las mariposas son muy sensibles a la fluctuación de variables ambientales como la temperatura, la estacionalidad, humedad relativa y radiación solar, entre otros (BROWN, 1991; MAHECHA-JIMÉNEZ et al., 2011; MAHECHA-J. & DÍAZ-S., 2015). Esta sensibilidad obedece a una respuesta comportamental y ecológica frente a las perturbaciones del hábitat generados por eventos antrópicos (GUERRA-SERRUDO & LEDEZMA-ARIAS, 2008; URBANO et al., 2014). Además, la sensibilidad de las mariposas a cambios ambientales y del paisaje, está relacionado con su ciclo de vida por las fuertes asociaciones de sus estados larvales a grupos particulares de plantas (GREENEY et al., 2009). Por lo anterior, las mariposas son considerados bioindicadores del estado de conservación del ecosistema, y al mismo tiempo, por presentar variabilidad espacio- temporal, por lo que suelen ser usados como modelos en estudios sobre variación temporal (FAGUA et al., 1999; GONZÁLEZ-VALDIVIA et al., 2011; URBANO et al., 2014; MAHECHA-J. & DÍAZ-S., 2015; ISERHARD et al., 2017).
La variación estacional o temporal puede afectar tanto a la estructura del hábitat como a la disponibilidad de recursos, lo que puede generar diferentes respuestas de las especies de mariposas y de otros grupos de animales como las aves (CODESIDO & BILENCA, 2004). Por ejemplo, algunas de estas respuestas pueden ser los cambios en la composición específica del ensamblaje de mariposas y las variaciones en abundancia de sus poblaciones (CODESIDO & BILENCA, 2004). A su vez, la actividad estacional de los insectos es un fenómeno que ha sido registrado muchas veces en ecosistemas tropicales donde hay una clara alternancia de una época seca y una húmeda (WOLDA, 1978; JIMÉNEZ-SÁNCHEZ et al., 2009). Sin embargo, esta estacionalidad puede variar según el grupo taxonómico que se esté estudiando y en general cada patrón representa una solución diferente de cada especie a las limitaciones locales en las condiciones bióticas y abióticas limitantes para cada especie (PESCADOR et al., 2002; JIMÉNEZ-SÁNCHEZ et al., 2009; ISERHARD et al., 2017), dando lugar a una gran variedad de patrones temporales o estacionales de diversidad (KATO et al., 1995; JIMÉNEZ-SÁNCHEZ et al., 2009).
Sin embargo, aún hacen falta estudios sobre varios temas biológicos, como por ejemplo en diversidad, biogeografía, sistemática, entre otros, concernientes a las mariposas en muchas regiones de Colombia, principalmente en aquellas áreas como el piedemonte y sabanas inundables de la Orinoquia, las cuales en los últimos años, han sido afectados por diferentes procesos antrópicos que ha llevado a la fragmentación del hábitat, como por ejemplo, actividades de minería, agricultura, ganadería extensiva, etc. (URBANO et al., 2014), además, la carencia de estudios sobre diversidad en la zona origina un desconocimiento de cómo diversos grupos animales, como las mariposas, responden a cambios ambientales y cómo estos cambios pueden afectar la estructura de los diferentes ensamblajes presentes en estas áreas del país, ejemplo de estos cambios ambientales tiene que ver con el conocimiento de los patrones de diversidad temporal, la cual permite una mejor comprensión de la ocurrencia y distribución de las especies en una comunidad, igualmente, la variación temporal influye en la fluctuación y modificación de las comunidades a través del tiempo permitiendo describir con precisión los patrones que dan forma a la diversidad y distribución de la fauna en un área determinada (ISERHARD et al., 2017). Por lo anterior, el objetivo del presente estudio fue determinar la variación temporal del ensamblaje de mariposas asociadas a la Cuenca de la Calaboza, Yopal, Casanare, Colombia. Además, de aportar al conocimiento de las especies de mariposas del departamento de Casanare.
Materiales y Métodos
ÁREA DE ESTUDIO
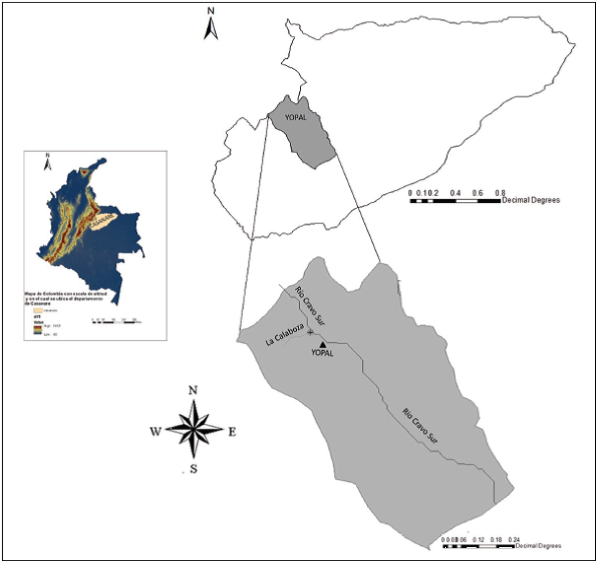
El estudio se realizó en la cuenca la Calaboza del municipio de Yopal Casanare, la cual comprende un ecosistema de bosque húmedo tropical sobre el piedemonte llanero de la cordillera oriental de Colombia (ROMERO et al., 2004). Esta cuenca presenta una altitud que va desde los 350 msnm hasta los 970 msnm y una precipitación media anual de 2.100 a 4.200 mm con un periodo de altas lluvias entre los meses de abril a octubre y un periodo de bajas lluvias entre los meses de noviembre a marzo. La topografía de la cuenca es típica de piedemonte llanero la cual está conformada, por diferentes tipos de suelos que se han originado gracias a la interacción que existe entré factores tales como la vegetación, el clima y la formación geológica de las rocas, causando dicha interacción suelos compuestos de hierro y aluminio, lo cual ostenta de superficies acidas al territorio. Está ubicada a 5 km al norte del casco urbano del municipio de Yopal (N: 5º 37’ 09”; W: 72º 41’ 81”) y tiene un área de 345 hectáreas donde predominan zonas abiertas de pastizales naturales e intervenidos y relictos boscosos sobre el margen del cuerpo de agua (Figura 1).
FASE DE CAMPO
La fase de campo se llevó acabo en los meses de V-VII-2016, que correspondió a la época de lluvia, y del mes XI-XII-2016 y I-2017, la cual consistió a la época de bajas lluvias. Para la recolección de los ejemplares se realizaron 6 salidas de campo de 5 días/mes cada una, en donde se utilizaron trampas Van Someren Rydon (VSR) en transectos de 300 metros cada uno sobre el margen del caudal, tanto en la cuenca alta como media y baja, sobre dichos transectos se colocaron 7 trampas distanciadas 50 metros una de la otra, las cueles se revisaron diariamente para el registro de ejemplares recolectados por trampa y por transecto. Las trampas fueron cebadas con fruta fermentada y excremento humano. Adicionalmente, se establecieron transectos paralelos en áreas abiertas o pastizales adyacentes, en los cuales se aplicó la metodología de captura con red lepidopterológica (jama) durante los 4 días por mes y logrando una intensidad de 132 horas/hombre por muestreo mensual.
DETERMINACIÓN TAXONÓMICA
Los individuos recolectados fueron procesados siguiendo el protocolo de ANDRADE-C et al. (2013) y fueron depositados en la colección de referencia de la Fundación Universitaria Internacional del Trópico Americano (Unitrópico) en Colombia. Se analizaron caracteres morfológicos como patrones alares, patrones de coloración y genitales del macho. Para la determinación taxonómica se utilizaron las claves de LECROM et al. (2002, 2004) y NEILD (1996, 2008). Adicionalmente, se contó con la colaboración de especialistas en algunos grupos de mariposas y su identificación fue contrastada con la lista para Lepidoptera neotropicales de LAMAS (2004) y la base de datos de WARREN et al. (2013).
ANÁLISIS DE DATOS
Se obtuvieron los índices de diversidad alfa y beta en términos de números equivalentes o números de Hill para la época de bajas lluvias y de altas lluvias. Estos números se calcularon en tres órdenes de diversidad; la diversidad en orden H0 (riqueza de especies), la diversidad H1 (exponencial del índice de Shannon) y la diversidad H2 (el inverso del índice de Simpson) (JOST, 2006; MORENO et al., 2011; CASAS-PINILLA et al., 2017). Se estimó la riqueza del muestreo por medio de los estimadores no paramétricos de Chao1, el cual analiza la riqueza cuando se obtiene la abundancia a partir de las especies observadas con una y dos muestras (singletons y doubletons) (MORENO, 2001; MAHECHA-JIMÉNEZ et al., 2011).
Además, se realizó una curva de acumulación de especies y una curva de rarefacción utilizando los sitios de muestreo como variable independiente y como variable dependiente las especies recolectadas (MAHECHA-JIMÉNEZ et al., 2011; URBANO et al., 2014; ISERHARD et al., 2017). Los patrones de abundancia de las especies se estimaron a partir de una matriz de abundancias, donde se estableció la curva de rangos de abundancias para el ensamblaje de mariposas, y de esta forma poder conocer que especies son más dominantes y cuales son raras (singletons y doubletons) en la muestra. Finalmente, se realizó una prueba de U-Mann Whitney (Test de Kolmogorov-Smirnov: p-value= 0.0002) para determinar la significancia entre la variación temporal de altas y bajas lluvias (ZAR, 1996). Todos los análisis se precisaron bajo un nivel de significancia del 95% (p>0,05) y se realizaron utilizando los programas Biodiversity Pro (MCALEECE et al., 1997) y SPSS (Statistical Productand Service Solutions Statistics) versión 17.0. (IBM, 2008).
Resultados
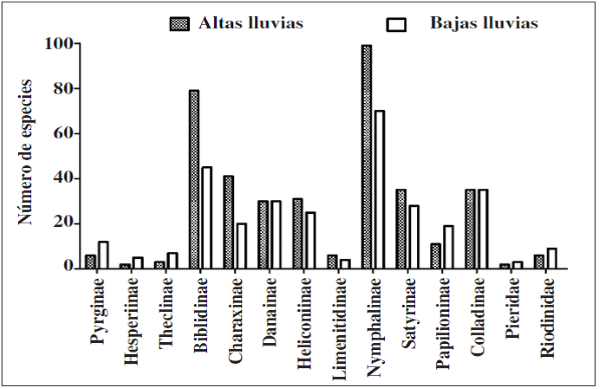
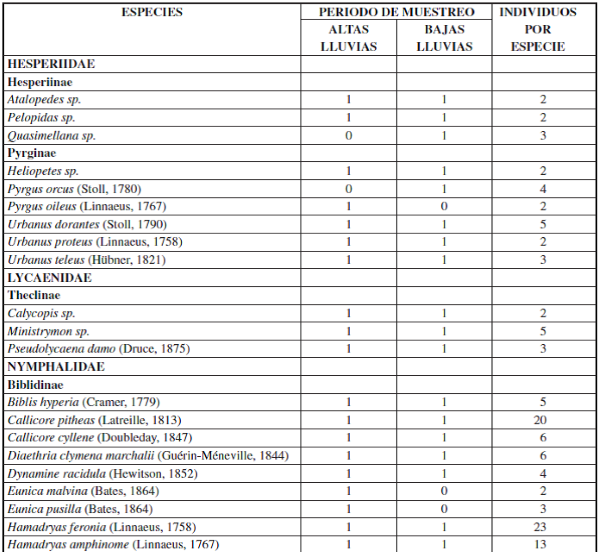
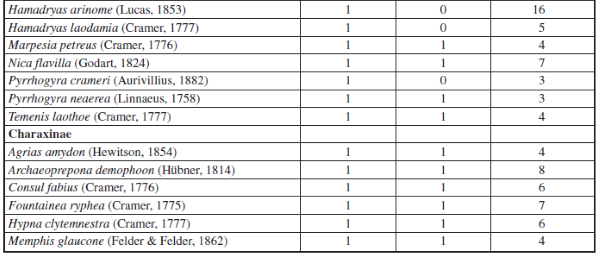
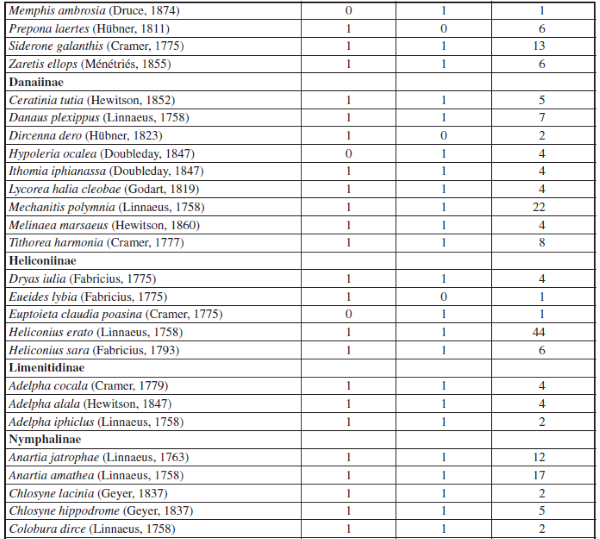
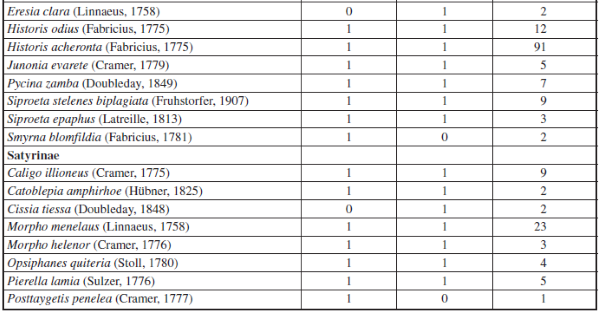
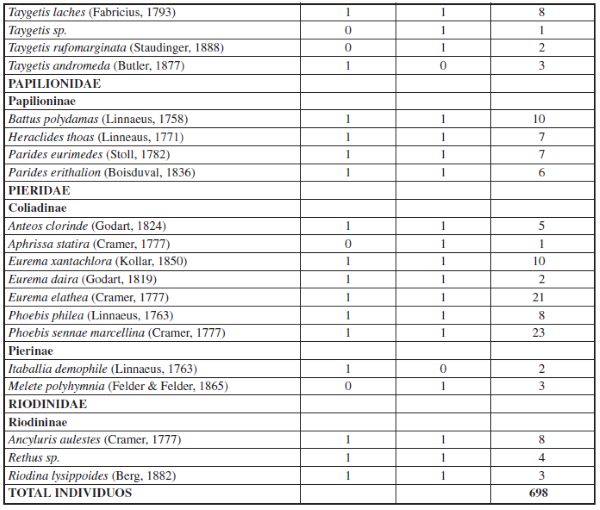
Se recolectaron 698 individuos, 6 familias, 15 subfamilias y 96 especies en ambas épocas (Apéndice I). En donde la familia Nymphalidae fue la más diversa tanto para la época de altas y bajas lluvias seguido de la familia Pieridae. Por su parte, las familias menos diversas fueron Papilionidae, Hesperidae, Lycaenidae y Riodinidae, siendo Lycaenidae y Riodinidae las familias que presentaron los menores valores de abundancia y riqueza en ambas épocas de muestreo (Figuras 2 y 3).
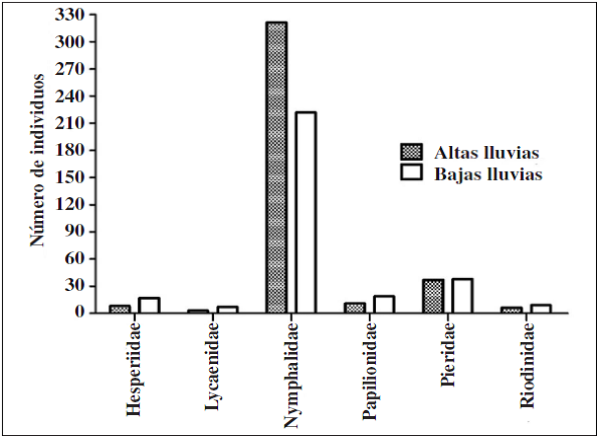
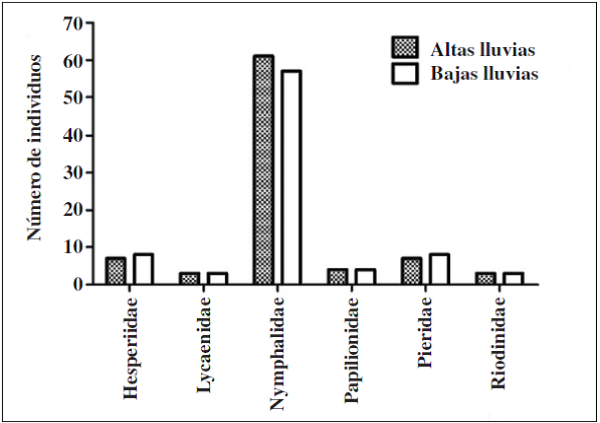
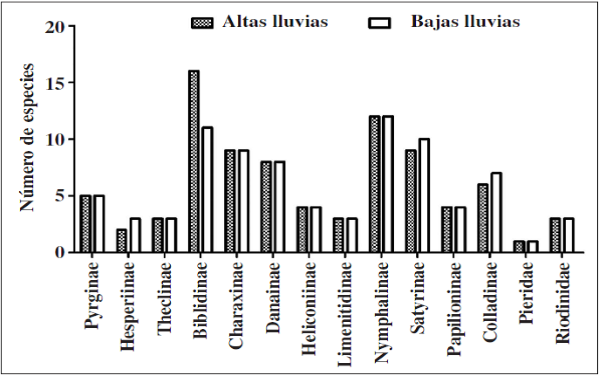
En cuanto a las subfamilias, Biblidinae y Nymphalinae (Nymphalidae) presentaron mayor riqueza y abundancia durante el estudio; subfamilias como Hesperiinae (Hesperiidae), Danaiinae (Nymphalidae) y Pierinae (Pieridae) fueron las menos representativas en la muestra tanto para la época de baja y alta lluvias (Figuras 4 y 5). Por su parte, en época de altas lluvias se recolectaron 386 individuos y 312 en bajas lluvias, aunque no se observaron diferencias significativas en términos de abundancia por época de muestreo en las subfamilias (U-Mann-Whitney: p= 0.236)
Además, se observó una variación en la composición de las especies de mariposas en ambas épocas de muestreo, por ejemplo: Pyrgus orcus (Stoll, 1780), Memphis ambrosia (Druce, 1874), Eresia clara (Linnaeus, 1758), Cissia tiessa (Doubleday, 1848), Quasimellana sp., Euptoieta claudia (Cramer, 1775), Taygetis rufomarginata (Staudinger, 1888), Aphrissa statira (Cramer, 1777), Melete polyhymnia (Felder & Felder, 1865) y Hypoleria ocalea (Doubleday, 1847) sólo se encontraron en la época de bajas lluvias, para un total de 11 especies exclusivas para la época de baja lluvias. Por su parte, se observaron 13 especies de mariposas únicas para la época de alta lluvias: Pyrgus oileus (Linnaeus, 1767), Eueideslybia (Fabricius, 1775), Itaballia demophile (Linnaeus, 1763), Dircenna dero (Hübner, 1823), Hamadryasarinome (Lucas, 1853), Taygetis andromeda (Butler, 1877), Eunica malvina (Bates, 1864), Posttaygetispenelea (Cramer, 1777), Smyrna blomfildia (Fabricius, 1781), Dircenna dero (Hübner, 1823), Preponalaertes (Hübner, 1811), Pyrrhogyra crameri (Aurivillius, 1882) y Hamadryas laodamia (Cramer, 1777) (Apéndice I).
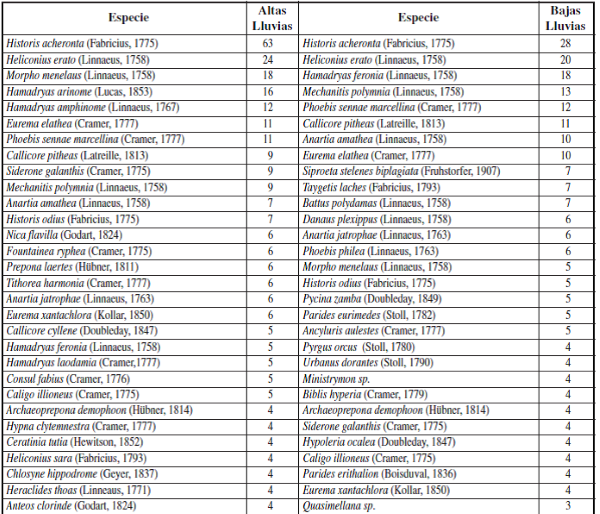
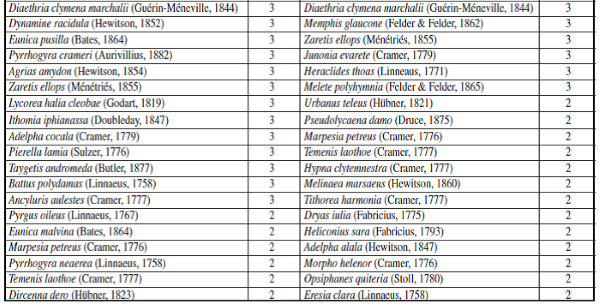
Por otro lado, se observó que la mayoría de especies de mariposas (72 especies) se presentaron tanto para la época de baja y altas lluvias, tales como: Urbanus dorantes (Stoll, 1790), Hamadryas feronia (Linnaeus, 1758), Dynamine racidula (Hewitson, 1852), Dryas iulia (Fabricius, 1775), Marpesiapetreus (Cramer, 1776), Fountainea ryphea (Cramer, 1775), Historis odius (Fabricius, 1775), Siproeta epaphus (Latreille, 1813), Taygetis laches (Fabricius, 1793), entre otras (Apéndice I). También, se observó que para ambas épocas hay una dominancia de algunas especies de mariposas en la muestra, como se puede constatar con los resultados de los rangos de abundancia (Figura 6), en donde la especie Historis acheronta (Fabricius, 1775) y Heliconius erato (Linnaeus, 1758) fueron las especies co-dominantes, tanto para época de baja y alta lluvias (Apéndice II).
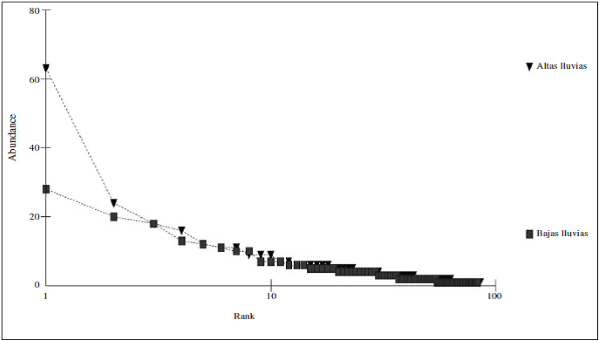
Según los estimativos de diversidad, se puede inferir que el valor del estimativo de los Números de Hill de orden H0 y H1 es mayor para la época de Bajas Lluvias, lo que significa que hay una mayor riqueza y diversidad en esta época en comparación con la época de Altas Lluvias, presentándose una mayor dominancia según el orden H2 en la época de Altas Lluvias (Tabla I). No obstante, el valor del orden H0 presenta valores más altos en relación con el orden H1 y H2, indicando que este ensamblaje presenta algunas especies abundantes y un gran número de especies raras para cada punto, lo que se corrobora con los resultados de los rangos de abundancias de especies (Figura 6).
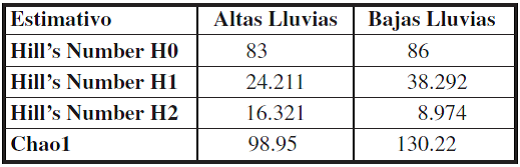
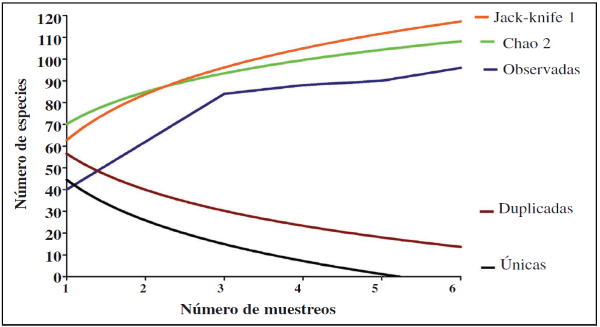
Al observar la curva de rarefacción se puede inferir que la riqueza esperada a partir de la observada aún es alta, lo que, a su vez, permite evidenciar que el esfuerzo de muestreo no fue suficiente, ya que la curva no se vuelve asintótica para ambas muestras (Figura 7). Lo anterior es corroborado por el estimativo no paramétrico de Chao1 (Tabla I), puesto que el valor estimado es mayor que el observado, lo que sugiere que con un mayor tiempo de muestreo se podrá obtener una mayor riqueza de mariposas para ambas épocas de muestreo, especialmente para la época de bajas lluvias.
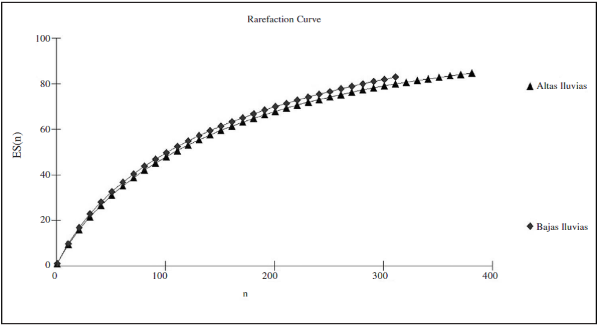
En cuanto a la curva de acumulación de especies (Figura 8), se observa que para ambas épocas de muestreo el esfuerzo de muestreo y la representatividad del mismo está entre un 80.6%-83.8%, por lo que la diversidad registrada para cada una de las muestras estuvo bien representada en el estudio a pesar de no llegar a un 100% de efectividad. Lo que perite inferir que, al igual que con la riqueza esperada, con un mayor tiempo de muestreo se podría llegar a obtener una mayor representatividad de especies de mariposas en el área de estudio según las épocas de muestreo.
Discusión
El patrón de actividad estacional registrado para la mayoría de las especies de mariposas y su relación con la precipitación (baja y altas lluvias), es un patrón que ha sido documentado también para otros grupos de insectos, como Coleópteros (PESCADOR et al., 2002; NOGUERA et al., 2007; JIMÉNEZ-SÁNCHEZ et al., 2009; MAHECHA-JIMÉNEZ et al., 2011; ISERHARD et al., 2017). Este patrón parece estar relacionado a la época reproductiva y a la disponibilidad de recursos en el hábitat (JIMÉNEZ-SÁNCHEZ et al., 2009). Por lo tanto, la actividad reproductiva de las especies de mariposas y otros grupos de insectos que mantienen una estrecha relación con las plantas como posibles hospederas o de refugio, estaría sincronizada con el tiempo de mayor disponibilidad de recursos para el desarrollo de sus larvas (JIMÉNEZSÁNCHEZ et al., 2009; URBANO et al., 2014; RIBEIRO et al., 2016).
Sin embargo, también se presentaron especies como Historis acheronta (Fabricius, 1775), Heliconiuserato (Linnaeus, 1758), Urbanus proteus (Linnaeus, 1758), Dynamine racidula (Hewitson, 1852), entre otras, las cuales estuvieron activas durante ambas épocas de muestreo y que aparentemente no siguen el patrón estacional de otras especies que sólo se presentaron en alguna época de muestreo, como Pyrrhogyra crameri (Aurivillius, 1882) y Cissia tiessa (Doubleday, 1848) (Apéndice I). Esta posible falta de estacionalidad de estas especies puede ser explicada por las preferencias de hábitat y los recursos alimenticios que estas especies explotan y que pueden versen afectadas por las condiciones de humedad visto desde una escala local (JIMÉNEZ-SÁNCHEZ et al., 2009). Es posible que las especies de mariposas que se presentaron únicamente tanto para la época de lluvias y de bajas lluvias, podrían ser consideradas univoltinas y esta es una posible explicación de que estén presentes sólo en alguna época del año, como sucede en coleópteros estafilínidos (JIMÉNEZ-SÁNCHEZ et al., 2009). No obstante, lo anterior no puede probarse en este estudio, aunque datos de MAHECHA-JIMÉNEZ et al., (2011) en mariposas Pronophilina y en especies de coleópteros de la familia Lampyridae y otros grupos de insectos con requerimientos de hábitat similares, parecen apoyar esta hipótesis (ZARAGOZA-CABALLERO et al., 2003; JIMÉNEZ-SÁNCHEZ et al., 2009).
Por otra parte, se ha demostrado que, a una escala local, variables ambientales como la altitud, la pendiente, la insolación y la capacidad de retención de agua del suelo, entre otras, pueden explicar cambios en la estructura y composición de la vegetación (DURÁN et al.,2002; JIMÉNEZ-SÁNCHEZ et al., 2009 MAHECA JIMÉNEZ et al.,2011; CASAS-PINILLA et al., 2017), lo que probablemente también afectaría la comunidad heterótrofa presente. En el caso de la región de estudio, la topografía es muy irregular y ello probablemente afecta las variables ambientales mencionadas anteriormente y origina una gran variedad de microhábitats con diferencias en estructura y composición de especies de flora y fauna (JIMÉNEZSÁNCHEZ et al., 2009; NAUJOKAITIS-LEWIS & FORTIN, 2016), lo que ocasiona una variación en la representatividad de las especies de mariposas en ambas épocas de muestreo, generando especies dominantes y especies raras en ciertas épocas del año.
A su vez, SHAPIRO et al. (2003) y ISERHARD et al. (2017) demostraron que la distribución temporal y diversidad de mariposas exhibe una gran variación entre diferentes épocas del año en relación con la fenología y la estacionalidad de estos insectos, por lo que la riqueza de especies y abundancia baja observada en algunas familias de mariposas como Lycaenidae y Riodinidae fueron probablemente debido a estas diferencias. Además, la dinámica en la estacionalidad afectará directamente a la biología de los inmaduros y mariposas adultas (ISERHARD et al., 2017). Estas dinámicas pueden explicarse por la extinción local, recolonización y/o por la migración a otros sitios o regiones en latitudes más bajas con mayor y más constante temperatura y con condiciones climáticas más favorables (ISERHARD et al., 2017). No obstante, los períodos muestreados en el presente estudio posiblemente no son suficientes para comprobar estos cambios en la dinámica poblacional de las especies de mariposas en el área de estudio. El empleo de los datos obtenidos en los estudios de variación temporal son fundamental para las estrategias de conservación, ya que esta información permite saber si las especies de mariposas están desapareciendo o si simplemente están migrando a otras zonas geográficas con condiciones abióticas y bióticas más favorables y si la planificación de la conservación está siendo efectiva por parte de las entidades gubernamentales encargadas de los procesos de conservación en el país (MAGURRAN, 2011; ISERHARD et al.,2017). La política pública también se beneficia de cierta manera, con la incorporación de información cien tífica relacionada con el mantenimiento de hábitats y la integridad de los biomas y su fauna asociada en el proceso de toma de decisiones para la conservación de especies y ecosistemas. Finalmente, este estudio aporta al conocimiento de cómo la variación temporal afecta a los ensamblajes de mariposas en la Orinoquía colombiana, como también contribuyendo a la composición de las especies de la región del Casanare en Colombia.
Agradecimientos
Los autores desean expresarle sus agradecimientos a la Fundación Universitaria Unitrópico por la financiación (Convocatoria Número 002-2016) del presente estudio. A todos los especialistas nacionales e internacionales que contribuyeron en la corroboración de las especies de Lepidoptera.
Referencias
ANDRADE-C., M. G., 2011.– Estado del conocimiento de la Biodiversidad en Colombia y sus amenazas. Consideracionespara fortalecer la interacción ciencia-política.– Revista Academia Colombiana de Ciencias, 35(137): 491-507.
ANDRADE-C., M. G., HENAO-BAÑOL, E. R. & TRIVIÑO, P., 2013.– Técnicas y procesamiento para la recolección, preservación y montaje de mariposas en estudios de biodiversidad y conservación (Lepidoptera: Hesperioidea-Papilionoidea).– Revista de la Academia Colombiana de Ciencias, 37(144): 311-325.
BAPTISTE, M. P., CASTAÑO, N., CÁRDENAS, L. D., GUTIÉRREZ, F. P., GIL, D. L. & LASSO, C. A., 2010.– Análisis de riesgo y propuesta de categorización de especies introducidas para Colombia: 56 pp. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Bogotá, D. C.
BROWN, Jr. K. S., 1991.– Conservation of Neotropical paleoenvironments: Insects as indicators.– In N. M. COLLINS & J. A. THOMAS (Eds). Conservation of Insects and their Habitats: 349-404. London. CASAS-PINILLA, L. C., MAHECHA-J., O., DUMAR-R., J. C. & RÍOS-MÁLAVER, I. C., 2017.– Diversidad de mariposas en un paisaje de bosque seco tropical, en la Mesa de los Santos, Santander, Colombia (Lepidoptera: Papilionoidea).–SHILAP Revista de lepidopterología, 45(177); 83-108.
CASAS-PINILLA, L. C., MAHECHA-J., O., DUMAR-R., J. C. & RÍOS-MÁLAVER, I. C., 2017.– Diversidad de mariposas en un paisaje de bosque seco tropical, en la Mesa de los Santos, Santander, Colombia (Lepidoptera: Papilionoidea).–SHILAP Revista de lepidopterología, 45(177); 83-108.
CODESIDO, M. & BILENCA, D. N., 2004.– Variación estacional de un ensamble de aves en un bosque subtropical semiárido del Chaco Argentino.– Biotropica, 36: 544-554.
DURÁN, E., BALVANERA, P., LOTT, E., SEGURA, G., PÉREZ-JIMÉNEZ, A., ISLAS, Á. & FRANCO, M., 2002.– Estructura, composición y dinámica de la vegetación.– In F. A. NOGUERA, J. H. VEGA-RIVERA, A. N. GARCÍA-ALDRETE & M. QUESADA-AVENDAÑO (eds.). Historia Natural de Chamela: 443-472. Instituto de Biología, Universidad Nacional Autónoma de México, México.
FAGUA, G., AMARILLO, A. & ANDRADE-C., M. G., 1999.– Mariposas (Lepidoptera) como bioindicadores del grado de intervención en la cuenca del río Pato (Caquetá).– In M. G. ANDRADE, G. AMAT & F. FERNÁNDEZ (eds). Insectos de Colombia: 285-315. Estudios Escogidos. Colección Jorge Álvarez Lleras. Academia Colombiana de Ciencias Exactas, Físicas y Naturales. Bogotá.
GONZÁLEZ-VALDIVIA, N., OCHOA-GAONA, S., POZO, C., FERGUSON, F. G., RANGEL-RUIZ, L. J., ARRIAGA- WEISS, S. L., PONCE-MENDOZA, A. & KAMPICHLER, C., 2011.– Indicadores ecológicos de hábitat y biodiversidad en un paisaje Neotropical: perspectiva multi-taxonómica.– Revista Biología Tropical, 59(3): 1433- 1451.
GUERRA-SERRUDO, J. F. & LEDEZMA-ÁRIAS, J., 2008.– Biología y morfología de Morpho menelaus godartii (Lepidoptera: Nymphalidae: Morphinae) en el Parque Nacional Cotapata Bolivia.– Ecología en Bolivia, 43(1): 40-52.
GREENEY, H. F., PYRCZ, T. W, DEVRIES, P. J. & DYER, L. A., 2009.– The early stages of Pedaliodes poesia (Hewitson, 1862) in eastern Ecuador (Lepidoptera: Satyrinae: Pronophilini).– Journal of Insect Science, 9: 1-8 IBM-SPSS Inc. Released 2008.– SPSS Statistics for Windows, Version 17.0. Chicago: SPSS Inc.
ISERHARD, C. A., PICCOLI-ROMANOWSKI, H., RICHTER, A. & MILTON DE SOUZA MENDONÇA, JR., 2017.– Monitoring Temporal Variation to Assess Changes in the Structure of Subtropical Atlantic Forest Butterfly Communities.– Environmental Entomology, 46(4): 804-813. https://doi.org/10.1093/ee/nvx115
JOST, L., 2006.– Entropy and diversity.– Oikos, 113: 363-375.
KATO, M., INOUE, T., HAMID, A. A., NAGAMITSU, T., MERDEK, M. B., NONA, A. R., ITINO, T., YAMANE, S. & YUMOTO, T., 1995.– Seasonality and vertical structure of light-attracted insect communities in a dipterocarp forest in Sarawak.– Researches on Population Ecology, 37: 59-79.
LAMAS, G., 2004.– Atlas of Neotropical Lepidoptera, Checklist:Part 4A, Hesperioidea-Papilionoidea: 439 pp. Association for Tropical Lepidoptera, Gainesville.
LE CROM, J. F., CONSTANTINO, L. M. & SALAZAR, J. A., 2002.– Mariposas de Colombia. Papilionidae, 1: 119 pp. Carlec Ltda. Bogotá
LE CROM, J. F, CONSTANTINO, L. M. & SALAZAR, J. A., 2004.– Mariposas de Colombia. Pieridae, 2: 113 pp. Carlec Ltda. Bogotá.
MAGURRAN, A. E., 2011.– Measuring biological diversity in time (and space): 85-96.– In A. E. MAGURRAN & B. J. MCGILL (eds.). Biological Diversity: Frontiers in measurement and assessment: 368 pp. Oxford University Press, Oxford.
MAHECHA-JIMÉNEZ, O. J., DUMAR-RODRÍGUEZ, J. C. & PYRCZ T. W., 2011. -Efecto de la fragmentación del hábitat sobre las comunidades de Lepidoptera de la tribu Pronophilini a lo largo de un gradiente altitudinal en un bosque andino en Bogotá (Colombia) (Lepidoptera: Nymphalidae, Satyrinae).– SHILAP Revista de lepidopterología, 39(153): 117-126.
MAHECHA-J., O. & DÍAZ-S., V., 2015.– Aproximación a la diversidad taxonómica de las mariposas diurnas (Lepidoptera: Papilionoidea) en la Vereda Cafrería, Municipio Icononzo, Tolima.– Revista Científica Unincca, 20(2): 83-91.
MCALEECE, N., GAGE, J. D. G., LAMBSHEAD, P. J. D. & PATERSON, G. L. J., 1997.– Biodiversity Professional statistics analysis software. Jointly developed by the Scottish Association for Marine Science and the Natural History Museum, London.
MORENO, C. E., 2001.– Métodos para medir la biodiversidad: 84 pp. Manuales y Tesis, Sociedad Entomológica Aragonesa, Zaragoza.
MORENO, C. E., BARRAGÁN, F., PINEDA, E. & PAVÓN, N. P., 2011.– Reanálisis de la diversidad alfa: alternativas para interpretar y comparar información sobre comunidades ecológicas.– Revista Mexicana de Biodiversidad, 82: 1249-1261.
NAUJOKAITIS-LEWIS, I. & FORTIN, M. J., 2016.– Spatio-temporal variation of biotic factors underpins contemporary range dynamics of congeners.– Global change biology, 22(3): 1201-1213.
NEILD, A., 1996.– The butterflies of Venezuela. Nymphalidae I (Limenitidinae, Apaturinae, Charaxinae), 1: 144 pp. Meridian Publications, Greenwich, London.
NEILD, A., 2008.– The butterflies of Venezuela. Nymphalidae II (Acraeinae, Libytheinae, Nymphalinae, Ithomiinae and Morphinae), 2: 144 pp. Meridian Publications Greenwich, London.
NOGUERA, F. A., CHEMSAK, J. A., ZARAGOZA–CABALLERO, S., RODRÍGUEZ-PALAFOX, A., RAMÍREZGARCÍA, E., GONZÁLEZ-SORIANO, E. & AYALA, R., 2007.– A faunal study of Cerambycidae (Coleoptera) from one region with tropical dry forest in Mexico: San Buenaventura, Jalisco.– The Pan-Pacific Entomologist, 83: 296-314.
PESCADOR-RUBIO, A., RODRÍGUEZ-PALAFOX, A. & NOGUERA, F. A., 2002.– Diversidad y estacionalidad de Arthropoda.– In F. A. NOGUERA, J. H. VEGA-RIVERA, A. N. GARCÍA–ALDRETE & M. QUESADAAVENDAÑO (eds.). Historia Natural de Chamela: 183-201. Instituto de Biología, Universidad Nacional Autónoma de México, México.
RIBEIRO, D. B., WILLIAMS, M. R., SPECHT, A. & FREITAS, A. V., 2016.– Vertical and temporal variability in the probability of detection of fruit-feeding butterflies and moths (Lepidoptera) in tropical forest.– Austral Entomology, 55(1): 112-120.
ROMERO, M., GALINDO, G., OTERO, J. & ARMENTERAS, D., 2004.– Ecosistemas de la cuenca del Orinoco Colombiano: 189 pp. Instituto de Investigaciones de Recursos Biológicos Alexander Von Humboldt. Bogotá.
RUDAS, G., DARWIN, M., ARMENTERAS, D., RODRÍGUEZ, N., MORALES, M., DELGADO, L. C. & SARMIENTO, A., 2007.– Biodiversidad y actividad humana: relaciones en ecosistemas de bosque subandino en Colombia: 128-130 pp. Instituto de Investigación de recursos biológicos Alexander von Humboldt. Bogotá.
SANTOS, T. & TELLERÍA, J. L., 2006.– Pérdida y fragmentación del hábitat: efecto sobre la conservación de las especies.– Ecosistemas, 15(2): 3-12
SHAPIRO, A. M., VANBUSKIRK, R., KAREOFELAS, G. & PATTERSON, W. D., 2003.– Phenophaunistics: Seasonality as a property of butterfly faunas: 111-148.– In C. L. BOGGS, W. B. WATT & P. EHRLICH (eds). Butterflies: ecology and evolution taken flight: 756 pp. The University of Chicago Press, Chicago.
URBANO, P., MAHECHA, J. O. & HINCAPIE, E., 2014.– Diversidad y estructura de las comunidades de Lepidoptera en la zona de ecotono entre el piedemonte llanero y sabana inundable en Casanare-Colombia (Lepidoptera: Papilionoidea).– SHILAP Revista de lepidopterología, 167(42): 433-437.
VAN DER HAMMEN, T. & ANDRADE, G., 2003.– Estructura Ecológica Principal de Colombia (primera aproximación): 74 pp. Ministerio de Ambiente e Ideam, Bogotá,Colombia.
WARREN, D., DAVIS, J., STANGELAND, M., PELHAM, J. & GRISHIN, N., 2013.– Illustrated Lists of American Butterflies. Disponible en http://www.butterfliesofamerica.com/ (accedido el 18 de mayo de 2017).
WOLDA, H., 1978.– Fluctuations in abundance of tropical insects.– The American Naturalist, 112: 1017-1045
ZAR, J. H., 1996.– Biostatistical analysis: 663 pp. Prentice Hall, Upper Saddle River, New Jersey.
ZARAGOZA-CABALLERO, S., NOGUERA, F. A., CHEMSAK, J. A., GONZÁLEZ-SORIANO, E., RODRÍGUEZPALAFOX, A., RAMÍREZ-GARCÍA, E. & AYALA, R., 2003.– Diversity of Lycidae, Phengodidae, Lampyridae, and Cantharidae (Coleoptera) in a tropical dry forest region in Mexico: Sierra de Huautla, Morelos.– The Pan-Pacific Entomologist, 7: 3-37.
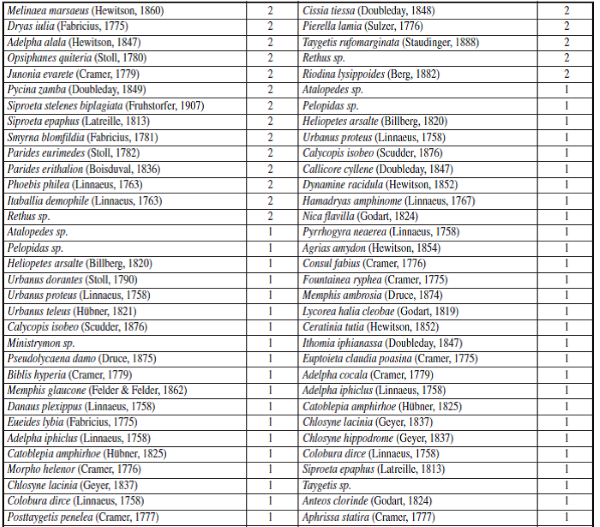
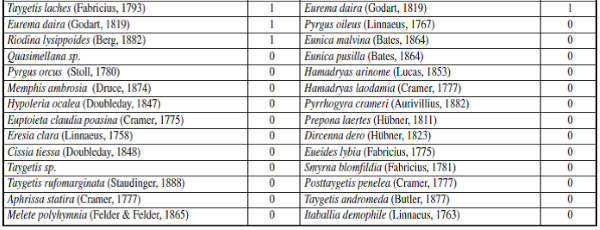
Apéndice I.– Composición y Abundancia de Mariposas Papilionoidea en cada época de muestreo en la cueca Colosal, Casanare, Colombia. El 0 representa ausencia y 1 presencia de la especie por época de muestreo.
Apéndice II.– Rango de Abundancias de especies para la época de muestreo de Altas y Bajas Lluvias.
Apéndice II.– Rango de Abundancias de especies para la época de muestreo de Altas y Bajas Lluvias.
Notas de autor
oscarmahecha23@gmail.com