Estimación del hábitat potencial de Satyrium w-album (Knoch, 1782) en la Península Ibérica y predicción de los efectos del cambio climático en su distribución para los años 2050 y 2070 (Lepidoptera: Lycaenidae)
Estimation of the potential habitat for Satyrium w-album (Knoch, 1782) in the Iberian Peninsula and prediction of the climate change effects on its distribution for the years 2050 and 2070 (Lepidoptera: Lycaenidae)
Estimación del hábitat potencial de Satyrium w-album (Knoch, 1782) en la Península Ibérica y predicción de los efectos del cambio climático en su distribución para los años 2050 y 2070 (Lepidoptera: Lycaenidae)
SHILAP Revista de lepidopterología, vol. 47, núm. 185, pp. 97-114, 2019
Sociedad Hispano-Luso-Americana de Lepidopterología
Recepción: 23 Mayo 2018
Aprobación: 30 Junio 2018
Publicación: 30 Marzo 2019
Resumen: En este trabajo se pretende aumentar el conocimiento de la posible distribución de Satyrium w-album en la Península Ibérica mediante el uso del modelo predictivo MaxEnt, estimándose la potencialidad del hábitat para esta especie bajo las condiciones bioclimáticas actuales, además de estimar la potencialidad del hábitat futura bajo los efectos del cambio climático para los años 2050 y 2070 usándose dos escenarios de posibles emisiones (RCP 4.5 y RCP 8.5). Los resultados obtenidos muestran una tendencia a la reducción de aquellas cuadrículas con potencialidad de hábitat alta (=0.55-1) para ambos periodos de tiempo y escenarios de emisión, siendo esta reducción mucho más pronunciada para el año 2070 bajo la RCP 8.5, quedando aquellas cuadrículas con una potencialidad alta relegadas a zonas con una elevada altitud.
Palabras clave: Lepidoptera, Lycaenidae, Satyrium w-album, modelo de distribución, MaxEnt, cambio climático, Península Ibérica.
Abstract: In this paper we try to increase the knowledge of possible distribution of Satyrium w-album in the Iberian Peninsula using the predictive model MaxEnt, estimated the potential of habitat for this species under current bioclimatic conditions, in addition to estimate the future potential of habitat under the climate change effects for the years 2050 and 2070 used two scenarios of possible emission (RCP 4.5 and RCP 8.5). The results show a tendency to reduce those grids with high habitat potentiality (=0.55-1) for both periods and emission scenarios. This reduction was more pronounced for the year 2070 under the RCP 8.5, leaving those grids with a high potentiality relegated to areas with a high altitude.
Keywords: Lepidoptera, Lycaenidae, Satyrium w-album, distribution model, MaxEnt, climate change, Iberian Peninsula.
Introducción
La especie Satyrium w-album (Knoch, 1782) es un Lepidoptera de distribución euroasiática, repartida por Europa, Turquía, Los Urales, Kazajistán y Japón. En Europa se extiende desde el norte de España, Italia (incluyendo Sicilia) y Grecia, hasta el sur de Reino Unido y el sur de Finlandia, en un rango altitudinal de 1.000-1.300 m (TOLMAN & LEWINGTON, 2008).
Posee una envergadura de 30-32 mm, siendo de color marrón oscuro, muy similar a otras especies del género, pero fácilmente reconocible por la línea blanca en forma de W y la mancha inferior naranja en el reverso de las alas posteriores, en las que además aparecen dos colas cortas. No posee un gran dimorfismo sexual, diferenciándose únicamente por la presencia en los machos de dos pequeñas manchas claras (androconias) en el anverso de las alas superiores. El imago vuela generalmente desde mediados y finales de junio hasta finales de julio y los primeros días de agosto en una sola generación (univoltina). Se trata de una especie típicamente forestal que habita en bosques maduros con claros soleados, ligada a zonas bien conservadas que cuenten con la presencia de la planta nutricia, tratándose esta principalmente de Ulmus glabra Huds (MUNGUIRA et al., 1997; TOLMAN & LEWINGTON, 2008; MURRIA-BELTRÁN, 2009). Debido a sus costumbres arborícolas, es una especie que pasa bastante desapercibida viéndose, los imagos de ambos sexos, atraídos por las flores de la zarza (Rubus sp.), entre otras. Hiberna en forma de huevo, que son depositados en la base de las yemas de hojas terminales, de los que emergerán las larvas a comienzos de la primavera, alimentándose de hojas y de brotes de flores en desarrollo (MORTERA, 2007; TOLMAN & LEWINGTON, 2008).
En la Península Ibérica, región en la que se centra el presente estudio, es una especie claramente septentrional, ligada a zonas de media montaña (GARCÍA-BARROS et al., 2004). Aunque no se encuentra recogida en el Atlas y libro rojo de los artrópodos amenazados de España, bajo ninguna categoría de amenaza, en la Península Ibérica GARCÍA-BARROS et al. (2004) la consideran como una especie rara. Su distribución es más abundante hacia el noreste peninsular, considerándose también como rara por algunos autores hacia el noroeste, en provincias como Asturias (MORTERA, 2007; ROMO & VELASCO, 2010), llegando hasta la Sierra de los Ancares (LÓPEZ & PINO, 1992b). Hacia el sur es menos frecuente, alcanzando por el Sistema Ibérico la provincia de Soria y por la Meseta norte la provincia de Valladolid, en la que encuentra su límite sur (GARCÍA-BARROS et al., 2004).
El uso de los olmos por parte de las larvas de S. w-album como planta nutricia, es un factor que hay que tener muy en cuenta para entender la distribución de esta especie en la Península Ibérica. En Europa, incluyendo la península, aparecen tres especies de olmo de forma natural: U. glabra (Olmo silvestre o de montaña), U. minor Mill. (Olmo de campo) y U. laevis Pall. (Olmo blanco) (NAVARRO & CASTROVIEJO, 2005; RODRÍGUEZ-CALCERRADA et al., 2011). A nivel peninsular la que posee una distribución más amplia es U. minor, que se encuentra repartida por todo el territorio español, mientras que U. glabra y U. laevis tienen una distribución más restringida. U. glabra aparece principalmente en el norte peninsular y de forma muy heterogénea en los Sistemas Central, Ibérico y Bético, ligado siempre a ambientes forestales eurosiberianos o submediterráneos, valles frescos y sistemas montañosos (ROSSIGNOLI & GÉNOVA, 2003). La distribución de U. laevis es muy fragmentada, apareciendo de forma puntual desde el norte hasta el sur peninsular (VENTURAS et al., 2013). Esta distribución tan poco pareja entre las tres especies es consecuencia de su diferente capacidad para responder al estrés hídrico. U. minor está adaptado a climas más cálidos típicamente mediterráneos, por lo que puede soportar períodos secos estivales moderados, mientras que U. glabra y U. laevis no soportan periodos secos superiores a un mes, encontrándose en suelos inundados o de descarga de acuíferos, pudiendo soportar largos periodos de inundación (COLLIN, 2003; VENTURAS et al., 2013).
Aunque en la actualidad no disponemos de datos para España, en Reino Unido las poblaciones de S. w-album han disminuido su área de ocupación (AOO) un 53% en los últimos 25 años, con una tendencia a la disminución poblacional de entre el 50 y el 79% en 10 años, por lo que según la IUCN se encuentra en la categoría de En Peligro (EN), bajo el criterio A2 b (FOX et al., 2011). Esta disminución poblacional es consecuencia del efecto que ha tenido la grafiosis del olmo, que ha diezmado las poblaciones de este árbol. Esta enfermedad es producida por los hongos Ophiostoma ulmi (Buism.) Nannf., O. novo-ulmi Brasier y O. himal-ulmi Brasier & M. D. Mehrotra. Las dos primeras especies también se conocen como especie no agresiva y agresiva respectivamente (SOLLA & GIL, 2001; DÍAZ et al., 2009). Aquellas zonas que se hayan visto afectadas por la grafiosis verán reducido el número de estas mariposas, especialmente si la enfermedad ha afectado a ejemplares de U. glabra, ya que es su principal planta nutricia, encontrándose además clasificada como una de las especies de olmo más susceptibles a la enfermedad (COLLIN et al., 2000), por lo que es de especial importancia la regeneración de U. glabra (MILLER, 2015) para la correcta conservación de esta mariposa.
Para llevar a cabo la correcta planificación de las medidas de conservación que se deben aplicar sobre una especie, es fundamental conocer su distribución y su respuesta a los cambios ambientales (ROMO et al., 2006). La distribución real de las mariposas diurnas es el resultado de la combinación de múltiples factores como pueden ser los ambientales (clima, altitud, usos del suelo) y los bióticos (competencia, depredación, herbivoría, parasitismo, disponibilidad de plantas nutricias, lugares de hibernación) (ROMO et al., 2012; DENNIS et al., 2013; OBREGÓN et al., 2014). El conocimiento actual de la distribución completa de esta especie puede no estar completo debido a la desigual prospección en las distintas zonas del norte de la península, siendo el Pirineo central (Huesca y Lérida) y el centro norte peninsular (La Rioja y País Vasco) aquellas zonas consideradas como bien muestreadas dentro de esta región (ROMO & GARCÍA-BARROS, 2005). Es aquí donde entra en juego el papel de los modelos predictivos para la estimación de los patrones de distribución potencial de una especie. Estos modelos se han convertido en una herramienta muy útil para el estudio de la distribución de especies y el posterior diseño de planes de conservación (WALDHARDT et al., 2004; OBREGÓN et al., 2014). Uno de los modelos más usados en la actualidad es el modelo de aprendizaje artificial de máxima Entropía, conocido como MaxEnt (PHILLIPS et al., 2006), que ha sido usado en varios trabajos sobre distribución potencial de los Lepidoptera diurnos, ya que permite estimar la idoneidad del hábitat a partir de datos de presencia de la especie concreta, evaluando la influencia de los distintos factores ambientales en aquellos puntos en los que exista la presencia de la especie (ROMO et al., 2012; OBREGÓN et al., 2014), valorando el número de presencias para determinar qué clase de entidad usar (MEROW et al., 2013). El uso de MaxEnt es muy extendido debido a su fácil manejo, pudiendo ser los datos de salida analizados de forma gráfica y estadística (MIRANDA-SIERRA et al., 2017). Además, modelos como MaxEnt permiten la estimación de aquellos hábitats más adecuados para una especie, tanto actuales como futuros, aunque no exista una gran número de muestras (OBREGÓN et al., 2014). Por estas razones se ha optado por el uso del modelo MaxEnt para la estimación de la distribución potencial de S. w-album.
Con este trabajo se pretende: (1) Generar un mapa actualizado de la distribución conocida de la especie junto con su planta nutricia (U. glabra) en la Península Ibérica, mediante la recopilación de datos procedentes de fuentes bibliográficas y bases de datos; (2) Generar mapas de distribución potencial de la especie en la Península Ibérica, para tres periodos temporales (actual, 2050 y 2070) bajo dos escenarios de emisiones de gases invernadero (RCP 4.5 y 8.5), con el fin de estimar el posible efecto del cambio climático sobre la distribución de esta especie.
Materiales y métodos
MAPA DE DISTRIBUCIÓN ACTUAL
Para la realización del mapa de distribución de S. w-album se han usado fuentes bibliográficas como atlas de mariposas diurnas, tanto a nivel peninsular como provincial, así como diversos artículos científicos en los que se ha trabajado con esta especie (LATASSA-ASSO, 1999; GARCÍABARROS et al., 2004; MORTERA, 2007; SANJURJO-FRANCH, 2007; GONZÁLEZ, 2008; MURRIA-BELTRÁN, 2009). De estas fuentes se han extraído la mayoría de las citas, las cuales corresponden a cuadrículas UTM de 10 x 10 km. También se han usado las coordenadas geográficas disponibles en la “Global Biodiversity Information Facility” (GBIF: https://www.gbif.org/).
Para generar tanto el mapa de distribución actual como los de la distribución futura se usó el programa de Información Geográfica ArcGis 10.4.1 (ESRI, 2015), representandose la distribución de S. w-album a una resolución de 10 x 10 km (cuadrículas UTM).
VARIABLES USADAS EN LOS MODELOS
Para generar los modelos de distribución potencial actual se han usado aquellas variables que puedan influir y determinar la presencia de la especie.
Como variables ambientales se han usado las variables bioclimáticas (BIOCLIM) descritas por HIJMANS et al. (2005), correspondientes a las condiciones actuales, generadas mediante la interpolación de los datos observados en el periodo 1960-1990. Estas variables se encuentran disponibles en la página del WorldClim (http://www.worldclim.org/version1). Se ha optado por trabajar con estas variables a una resolución de 5 minutos ya que es la que mejor se ajusta a la resolución (cuadrículas de 10 x 10 km) de la mayoría de los datos de presencia de la especie (ROMO et al., 2012). Se han usado 5 de las 19 variables bioclimáticas disponibles, elegidas por no presentar una fuerte correlación entre sí (r < 0,8), como reflejan varios autores (OBREGÓN et al., 2014; ROMO et al., 2012). Además, estas 5 variables también han sido elegidas por ajustarse de forma adecuada a los requerimientos ecológicos de la mariposa. Estas variables son; Bio1 (Temperatura media anual, ºC), Bio10 (Media de temperatura del trimestre más cálido, ºC), Bio11 (Media de temperatura del trimestre más frío, ºC), Bio12 (Precipitación anual, mm) y Bio18 (Precipitación del trimestre más cálido, mm).
Para la realización de los modelos de distribución bajo los efectos del cambio climático, se emplearon las mismas 5 variables bioclimáticas que en el modelo de distribución actual, bajo una proyección futura y una resolución de 5 min. Las variables fueron extraídas del WorldClim (http://www.worldclim.org/cmip5_5m). Se eligieron las variables generadas por el modelo de circulación general MRI-CGCM3, desarrollado por el Meteorological Research Institute (MRI), capaz de reproducir el estado medio básico y la variabilidad en el sistema climático para investigar a escala global y subcontinental el cambio climático (YUKIMOTO et al., 2012), propuesto en la fase 5 del Proyecto de Inter-Comparación de Modelos Acoplados (CMIP5). Como las emisiones de CO2 pueden variar en el futuro dependiendo de las actividades humanas a lo largo del tiempo, los modelos se realizan bajo diferentes escenarios o proyecciones de emisiones, denominadas Representative Concentration Pathway (RCP), existiendo cuatro tipos (RCP 2.6, RCP 4.5, RCP 6.0 y RCP 8.5) atendiendo al forzamiento radiativo después del año 2100 (FORSTER et al., 2013; IPCC, 2014). De estos escenarios se eligieron el RCP 4.5 y el RCP 8.5, por representar la estabilización y el aumento de las emisiones de CO2 respectivamente, pasado el año 2100 (DUNNE et al., 2013; IPCC, 2014). Gracias a este tipo de modelos climáticos se pueden modelizar la distribución de especies animales y vegetales en el futuro. Concretamente, el modelo usado en este trabajo simula el clima hasta el año 2050 (promedio entre 2041-2060) y 2070 (promedio entre 2061-2080), lo que ha permitido modelizar la distribución potencial de S. w-album en la Península Ibérica para estos dos periodos.
Como variable topográfica de elevación se ha empleado un modelo digital de elevación (MDE) a nivel peninsular.
Dada la estrecha relación de la especie con su planta nutricia, U. glabra, se ha realizado un mapa de presencia de la especie vegetal, con una resolución de 10 x 10 km. A cada cuadrícula con presencia de esta planta se le ha asignado un valor de 1, y a aquellas zonas desprovistas de ella un valor de 0. El mapa se ha elaborado a partir de información extraída de fuentes bibliográficas (ROSSIGNOLI & GÉNOVA, 2003) y del proyecto LIFE: Restauración de los olmos ibéricos 13/BIO/ES/000556 (http://www.olmosvivos.es). Debido a que los olmos son árboles ubicuistas y habitualmente siguen cursos de agua (TEMPLADO, 1983), se ha elaborado un segundo mapa de vegetación, en el que se recogen aquellas formaciones arbóreas ligadas a cursos de agua como son las saucedas, choperas y alisedas. Este mapa se ha elaborado a partir de información extraída del Mapa Forestal de España (http://www.mapama.gob.es/es/biodiversidad/servicios/banco-datos-naturaleza/informaciondisponible/mfe200.aspx).
Como última capa se usó el mapa de ocupación del suelo de España, correspondiente al proyecto europeo Corine Land Cover (CLC), cedida por el © Instituto Geográfico Nacional (IGN).
MODELIZACIÓN DE LA DISTRIBUCIÓN POTENCIAL
La modelización de los mapas de distribución potencial se realizó mediante el programa informático MaxEnt v3.4.0. El modelo se configuró siguiendo la función logística, ya que esta es la más fácil de conceptualizar debido a que nos devuelve unos valores estimados entre cero y uno de probabilidad de presencia, lo que facilita en gran medida su interpretación (PHILLIPS et al., 2004; PHILLIPS et al., 2006). En la calibración del modelo se especificaron un número máximo de interacciones de 500, 10.000 puntos de fondo y el límite de convergencia se fijó en 0.00001 (valores por defecto), realizándose 100 réplicas por cada modelo. Para determinar calidad de la predicción de la distribución potencial por parte del modelo, se usó la técnica de validación simple Receiver Operating Characteristic (ROC), en la que se usó un 25% de los registros de la muestra para la medición de la calidad del modelo. También se aplicó la técnica de validación cruzada sobre las diferentes réplicas del modelo. Tras el uso de la técnica de validación ROC se obtuvieron los valores promedio de AUC (Area Under the (ROC) Curve) para cada modelo. Estos valores AUC, comprendidos entre 0 y 1, nos indican si el modelo es preciso o no, considerándose como modelos de alta precisión aquellos cuya AUC se encuentre entre 0,7 y 1 (PEARCE & FERRIER, 2000; ARAÚJO et al., 2005; NEWBOLD et al., 2009), siendo los más precisos aquellos con valores superiores a 0.9 (BOYCE et al., 2002).
Se usaron los valores de los once test binomiales de la prueba binomial de omisión que genera MaxEnt, que sirve como complemento en la evaluación del modelo. Estos once test son: valor fijo acumulado 1, valor fijo acumulado 5, valor fijo acumulado 10, valor mínimo de presencia de entrenamiento, valor del percentil 10 de presencia de entrenamiento, valor de la igualdad de la sensibilidad y especificidad de entrenamiento, máximo valor de la sensibilidad más la especificidad de prueba, valor de la igualdad de la sensibilidad y especificidad de prueba, máximo valor de la sensibilidad más la especificidad de prueba, balance en la omisión de entrenamiento (área predicha y valor umbral) e igualdad entre la entropía del umbral y las distribuciones originales. Los valores de significación de estos once tests tienen que ser de p<0.01 para que la predicción del modelo sea aceptable (ROMO et al., 2012).
Para comprobar adicionalmente la eficacia del modelo se ha realizado el cálculo la sensibilidad, fijando como valor umbral logístico el valor de ETSS (Equal Training Sensitivity and Specificity), como han hecho otros autores con anterioridad (FIELDING & BELL, 1997; OBREGÓN et al., 2014). Se usó la prueba de Jackknife, ya que resulta muy útil para evaluar el porcentaje de contribución de cada variable al modelo final (PETERSON & COHOON, 1999). Esta metodología se realizó sobre todos los modelos, tanto en el de distribución actual como en los de distribución futura (2050 y 2070), bajo los dos escenarios de emisiones elegidos (RCP 4.5 y RCP 8.5), generándose cinco modelos; Actual, 2050 (RCP 4.5), 2070 (RCP 4.5), 2050 (RCP 8.5) y 2070 (RCP 8.5), nombrándose de forma abreviada; A, B, C, D y E respectivamente. Se usó la media de cada uno de los modelos para la visualización de los resultados en mapas de distribución.
Para la representación gráfica y tratamiento de los datos obtenidos de los modelos de distribución, se ha empleado el software estadístico RStudio (RSTUDIO TEAM, 2016).
Resultados
MAPA DE DISTRIBUCIÓN ACTUAL
La revisión bibliográfica que se ha llevado a cabo sobre aquellos trabajos en los que existen citas de la distribución de S. w-album, han reportado un total de 106 cuadrículas UTM de 10 x 10 km. A su vez, las coordenadas referentes al GBIF (23 localidades), han reportado 10 nuevas cuadrículas UTM de las que no existía registro en la bibliografía. Por tanto, el mapa de distribución conocida (Figura 1A) cuenta con un total de 116 Cuadrículas UTM de 10 x 10 km, lo que amplía en 29 cuadrículas el mapa de distribución de GARCÍA-BARROS et al. (2004), el más completo hasta la fecha y que contaba con 87 cuadrículas.
El mapa de distribución conocida de S. w-album se ha elaborado junto con las cuadrículas UTM donde se conoce la presencia de U. glabra (Figura 1A).
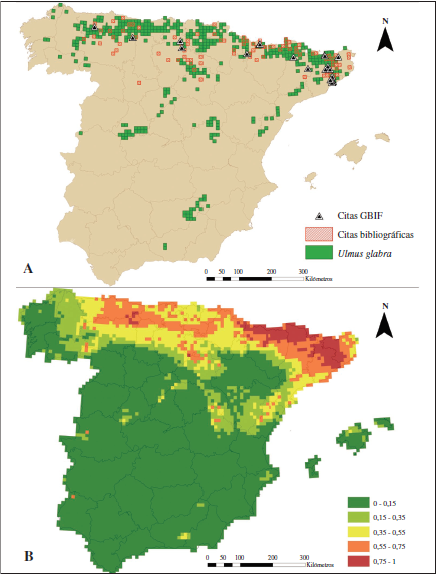
Figura 1.
1.A) Mapa de distribución conocida en cuadrículas UTM 10 x 10 km para U. glabra y S. w-album, junto con las citas de presencia de S. w-album extraídas del GBIF. 1.B) Modelo A de distribución potencial generado usando MaxEnt bajo las variables bioclimáticas y bióticas actuales. El valor de la potencialidad de hábitat más alta aparece en rojo (0.75-1) y el más bajo en verde (0-0.15).
DISTRIBUCIÓN POTENCIAL ACTUAL (MODELO A)
Mediante el uso del análisis MaxEnt se ha obtenido el mapa de distribución potencial actual para S. w-album (Figura 1B). En él, se muestra la idoneidad del nicho potencial mediante un código de colores, comprendido entre 0 y 1 según la probabilidad de hábitat potencial, considerándose como alta a aquellos valores comprendidos entre 0.55 y 1. Se puede observar que las regiones con alta probabilidad de hábitat potencial se encuentran restringidas al norte peninsular en; la Cordillera Cantábrica, los Pirineos, la cordillera costera catalana y hacia la depresión del Ebro en la Sierra de Guara y del Montsec. Existiendo además otra zona de alta potencialidad en la Sierra de la Demanda, al norte del Sistema Ibérico.
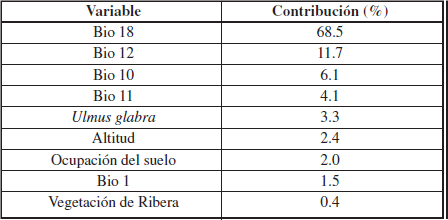
A través del uso de la prueba de Jackknife, que realiza MaxEnt, se ha determinado el porcentaje de contribución de cada variable al modelo (Tabla I). Las variables que más han contribuido al modelo han sido las cinco variables ambientales, con un porcentaje total del 91.9% de contribución. De entre estas variables ambientales la que más contribución es la Bio 18 o precipitación del trimestre más cálido, con un 68.5%, mientras que la Bio 1 contribuye poco, con 1.5%. Las cuatro variables restantes contribuyen mínimamente, encontrando que las variables de vegetación (U. glabra y vegetación de ribera) contribuyen un 3.3% y 0.4% respectivamente.
La curva ROC obtenida en el modelo (Figura 2), cuenta con un valor AUC de 0.9534. Al ser este valor superior a 0.9, se toma el modelo como aceptable, ya que se considera más preciso que un modelo obtenido al azar. El valor umbral logístico ETSS fue de 0.224 y la sensibilidad obtenida mediante el uso de este valor umbral de 0.83.
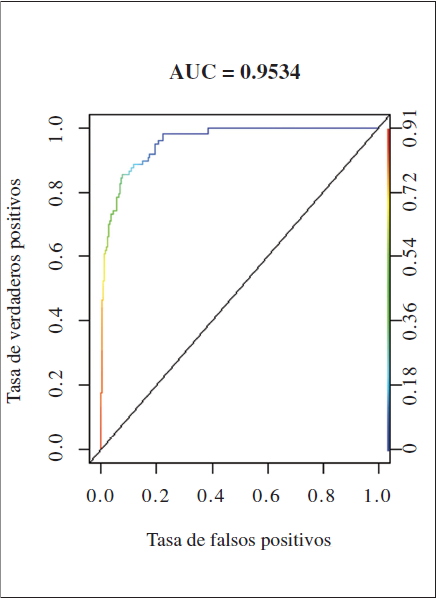
Figura 2.
Curva ROC (Receiver Operating Characteristic) y valor AUC (Area Under the Curve) obtenidos en la evaluación de la calidad del modelo.
La prueba de omisión binomial mostró valores con una significación de p<0.01 para los once tests binomiales, siendo la predicción del modelo aceptable.
DISTRIBUCIÓN POTENCIAL FUTURA (MODELOS B, C, D Y E)
Los modelos de distribución futura (Figuras 3 y 4), en comparación con el actual (modelo A), muestran una disminución en el número de cuadrículas con una potencialidad igual o superior a 0.55 (Figura 5).
Comparando estos modelos futuros con el actual (Tabla II), se ha obtenido que: 1) Para 2050 bajo una RCP 4.5, se prevé una disminución del 49.14% (=0.75) y del 28.98% (=0.55) de las cuadrículas totales, y bajo una RCP 8.5 una disminución del 80.35% (=0.75) y del 71.66% (=0.55). 2) Para el 2070 con una RCP 4.5 la reducción es del 79.38% (=0.55) y del 95.96% (=0.75), y con una RCP 8.5 del 91.34% (=0.55) y del 97.69% (=0.75).
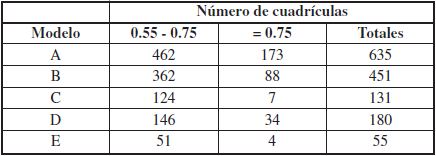
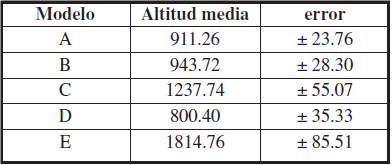
La altura media de aquellas cuadrículas con potencialidad de hábitat =0.55 (Tabla III y Figura 6) es similar para los periodos A (actual) y B (2050, RCP 4.5). La media de alturas va a desplazarse hacia valores de altitud mayor para los periodos C (2070, RCP 4.5) y E (2070, RCP 8.5).
De forma general, para los años 2050 y 2070, se aprecia una disminución en el área de potencialidad =0.55 (Figuras 3 y 4), en comparación con el modelo para el periodo actual (Figura 1B). Además, encontramos que esta disminución es mayor en la Cordillera Cantábrica que en los Pirineos, intensificándose para el año 2070 bajo la RCP 8.5.
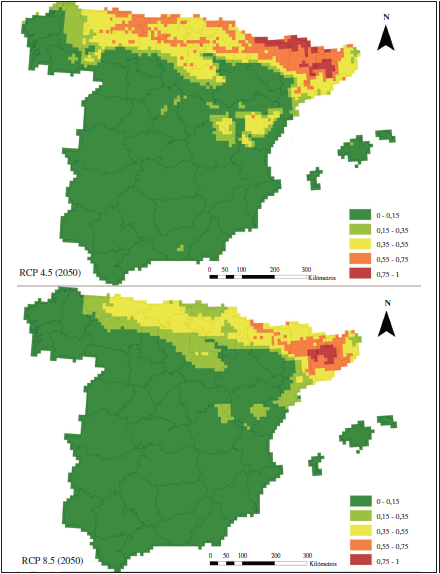
Figura 3.
Modelos de distribución potencial B y D para el año 2050, generados usando MaxEnt bajo el escenario de circulación general MRI-CGCM3 de cambio climático. Se representan los escenarios RCP 4.5 (modelo B) y RCP 8.5 (modelo D) de emisiones futuras. El valor de la potencialidad de hábitat más alta aparece en rojo (0.75 – 1) y el más bajo en verde (0-0.15).
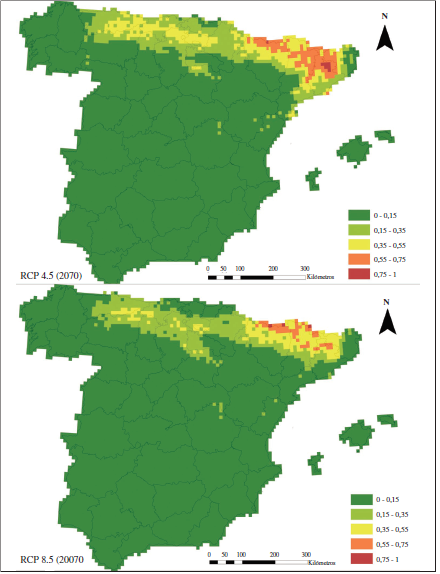
Figura 4.
Modelos de distribución potencial C y E para el año 2070, generados usando MaxEnt bajo el escenario de circulación general MRI-CGCM3 de cambio climático. Se representan los escenarios RCP 4.5 (modelo C) y RCP 8.5 (modelo E) de emisiones futuras. El valor de la potencialidad de hábitat más alta aparece en rojo (0.75-1) y el más bajo en verde (0-0.15).
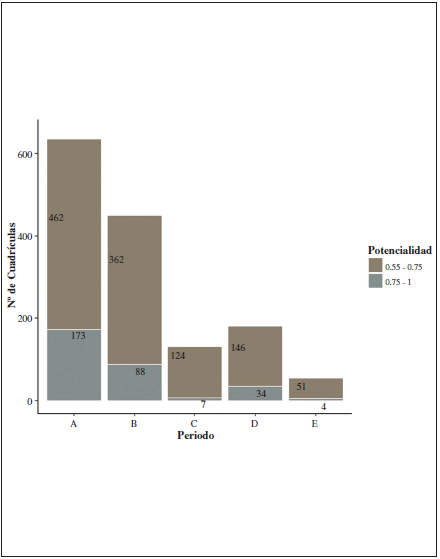
Figura 5.
Número de cuadrículas UTM de 10 x 10 km con una potencialidad de hábitat =0.55 para el periodo actual (modelo A) y los años; 2050 - RCP 4.5 (modelo B), 2070 - RCP 4.5 (modelo C), 2050 - RCP 8.5 (modelo D) y 2070 - RCP 8.5 (modelo E).
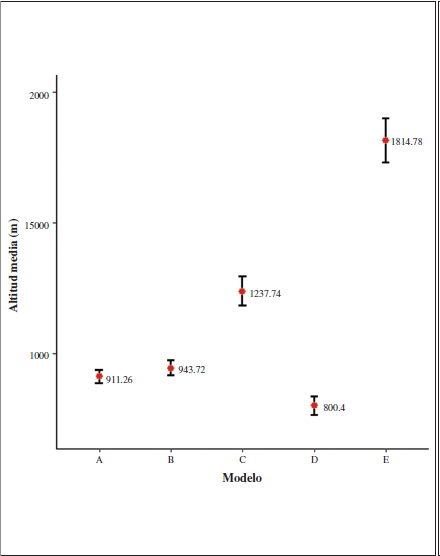
Figura 6
Altitud media y error estándar (intervalo de confianza del 95%) de las cuadrículas con potencialidad de hábitat =0.55 para los cinco modelos analizados; periodo actual (modelo A) y los años; 2050 - RCP 4.5 (modelo B), 2070 - RCP 4.5 (modelo C), 2050 - RCP 8.5 (modelo D) y 2070 - RCP 8.5 (modelo E).
Discusión
Es difícil conocer la distribución real y completa de una especie, por lo que en la actualidad el uso de modelos para estimar la potencialidad de hábitats donde se pudiera encontrar la especie estudiada es de gran utilidad, ya que mediante el uso de estas herramientas podemos evaluar la susceptibilidad y vulnerabilidad de las especies al cambio climático (HEIKKINEN et al., 2010) así como el posterior diseño de planes de conservación (WALDHARDT et al., 2004). De esta forma, se puede estimar la posible distribución potencial de especies de mariposas, para distintos periodos de tiempo y bajo diferentes proyecciones climáticas o escenarios de emisión (ROMO et al., 2012).
Según el modelo A, realizado para el periodo actual y al igual que su distribución conocida, la distribución de Satyrium w-album está restringida al tercio norte peninsular, en áreas con rangos climáticos similares y de media montaña. Gran parte de las cuadrículas con alta potencialidad (=0.75) se sitúan sobre dos de las áreas con mayor diversidad de especies de mariposas en la Península Ibérica, como son el Parque Natural de Ordesa y Monte Perdido (Huesca) y Viella (Lérida) (ROMO et al., 2007), además de otras zonas situadas en los Pirineos y la cordillera costera catalana. Por tanto, la mayor parte de las cuadrículas estimadas con una alta potencialidad quedan relegadas al noreste peninsular, sobre los Pirineos y la cordillera costera catalana, exceptuando ocho cuadrículas situadas en la Cordillera Cantábrica y una al norte del Sistema Ibérico.
Para el año 2050 bajo la RCP 4.5 (modelo B), la distribución potencial se asemejaría bastante al modelo actual, donde, pese a la reducción, todavía se encontrarían zonas muy favorables en los Pirineos, la cordillera costera catalana y la Cordillera Cantábrica, aunque sobre ésta, ya no aparecerían reductos con potencialidad =0.75. Sin embargo, para el resto de los modelos la situación cambia radicalmente. La Cordillera Cantábrica pierde todas sus cuadrículas con potencialidad =0.55 tanto en el modelo D (2050, RCP 8.5) como para el modelo C (2070, RCP 4.5), quedando todos los relictos de alta potencialidad en el noreste peninsular, sobre los Pirineos y la cordillera costera catalana. La potencialidad predicha en el modelo E (2070 bajo la proyección de emisiones más severa; RCP 8.5) queda restringida a los Pirineos en cotas altas.
Esta restricción de la potencialidad de hábitat futura a las cotas de mayor altitud puede deberse a que los pisos de menor elevación cuentan con una variación climática mayor que en los pisos superiores, siendo los de mayor altitud aquellos con mejores condiciones climáticas para albergar especies de mariposas susceptibles al cambio climático, produciéndose consecuentemente un aumento en la riqueza de especies en los pisos superiores (KONVICKA et al., 2003; WILSON et al., 2007). Este aumento en la riqueza de especies con la altitud también está teniendo lugar en plantas, siendo las cimas montañosas colonizadas por nuevas especies a un ritmo considerable (STEINBAUER et al., 2018), lo que podría resultar beneficioso para las mariposas si alguna de estas especies de plantas les sirviera de planta nutricia y forrajera.
Los factores bióticos pueden ser clave bajo los efectos del cambio climático (ARAÚJO & LUOTO, 2007), existiendo una amplia evidencia de que en las últimas décadas se están produciendo cambios en la fenología de muchas especies, tanto en los periodos de floración (VISSER & BOTH, 2005) como en la fecha de la primera aparición de las mariposas, que en la mayoría de las especies se ha adelantado durante los últimos 30 años (ROY & SPARKS, 2000; DIAMOND et al., 2011). Esto supone un riesgo para los Lepidoptera, ya que las larvas podrían emerger en un periodo más desfavorable, donde la fenología de las plantas nutricias no fuera la idónea. Dado que la principal planta nutricia de S. w-album es U. minor, es de especial interés el estudio del estado de conservación de sus poblaciones. Aunque en nuestro modelo la contribución de las variables bióticas de vegetación sólo ha sido de un 3.7%, comparando los mapas de distribución de U. glabra (Fig. 1A) y el mapa de predicción actual (Fig. 1B), vemos, como cabría esperar por ser su principal planta nutricia, que la mayor parte de las zonas con alta potencialidad coinciden con zonas donde las citas de U. glabra son abundantes, como en los Pirineos, la cordillera costera catalana y la Cordillera Cantábrica (ROSSIGNOLI & GÉNOVA, 2003).
Al ser un árbol de montaña, que sigue zonas húmedas, es susceptible a los periodos secos (COLLIN, 2003), por lo que podría verse especialmente afectado en la Península Ibérica, donde se prevé un aumento en la intensidad de los periodos estivales (SOMOT et al., 2008; DE LUIS et al., 2010). Además de un aumento en la demanda de agua para irrigación, afectando negativamente a la conservación de este árbol (VENTURAS et al., 2013). Junto con la amenaza del cambio climático y las acciones antrópicas para este árbol, hay que tener muy en cuenta el efecto de la grafiosis y sus posibles consecuencias, tanto para la distribución del mismo como para la de la mariposa. Esta reducción en la principal planta nutricia podría poner en riesgo las poblaciones de S. w-album en la Península Ibérica, ya que la calidad del hábitat donde se encuentran los estados larvales de las mariposas es uno de los factores más importantes a la hora de determinar tanto el tamaño como la persistencia de sus poblaciones (THOMAS et al., 2011).
La baja contribución obtenida al modelo de las variables de vegetación (3.7%), indica que los resultados que arroja el modelo han sido calculados mayoritariamente empleando valores bioclimáticos, por lo que aquellas citas históricas situadas en zonas con condiciones bioclimáticas desfavorables pueden deberse a la interacción con; factores abióticos no tenidos en cuenta, a la interacción con los factores bióticos aquí mencionados como plantas nutricias y vegetación en general o tratarse de citas erróneas por errores de identificación o georreferenciación. Dentro de estas variables bioclimáticas las que más contribuyeron al modelo fueron aquellas relacionadas con la disponibilidad de agua, como la Bio18 y la Bio12, con un 68.5 y 11.8% respectivamente. Aunque es bien sabido que la dinámica poblacional de mariposas es sensible a la temperatura (UVAROV, 1931; DENNIS, 1993), en nuestro caso, las variables Bio10 y Bio11 han tenido una reducida contribución, contribuyendo al modelo en un 6.1 y 4.1% respectivamente. Esto refleja que desde un punto de vista bioclimático las precipitaciones, en especial las del trimestre más cálido (Bio18), son las que más pueden limitar la distribución de Satyrium w-album.
Además, las actividades antrópicas directas como cambios en la ocupación del suelo para el uso agrícola, ganadero, urbano, uso de pesticidas o construcción de infraestructuras también puede alterar y reducir el hábitat de esta mariposa y poner en peligro su estado de conservación en el futuro si estas actividades se llevan a cabo en zonas donde la presencia de esta especie es escasa o no es bien conocida.
En la actualidad no se puede considerar que esta especie se encuentre en peligro, ya que posee un área de distribución relativamente amplia. Sin embargo, la drástica reducción de su área de distribución predicha por el modelo para el año 2070, debido a cambios fundamentalmente bioclimáticos como efecto del cambio climático puede poner gravemente en riesgo su presencia en la Península Ibérica, estimándose una reducción en las cuadrículas totales (=0.55) del 79.38% bajo la RCP 4.5 y del 91.34 % bajo la RCP 8.5.
Al tratarse de una especie con una tendencia especialista en la elección de plantas nutricias hace que sea más susceptible a cambios producidos en el entorno (DENNIS et al., 2004) como los efectos del cambio climático antes expuestos, pudiendo llegar a desaparecer en determinadas zonas, por lo que el diseño y puesta en marcha de un correcto plan de conservación sobre esta especie sea fundamental para su presencia en la Península Ibérica a finales de este siglo.
De acuerdo con los datos obtenidos en este trabajo es necesario seguir realizando estudios poblacionales sobre esta mariposa, que ayuden a conocer nuevas áreas de distribución con el fin de elaborar modelos de distribución cada vez más precisos y así poder diseñar planes de conservación lo más eficaces posibles. Dado que este estudio se basa en variables bioclimáticas, sería de gran ayuda realizar nuevos trabajos de estas características, aumentando el espectro de variables empleadas, como el uso de un mayor número de variables bióticas que puedan influir sobre la especie. Dada la estrecha relación de S. w-album con U. glabra una de las medidas aconsejables para su conservación sería la plantación de nuevos ejemplares de este árbol. Cabe destacar que esta plantación se debe realizar generando nuevas manchas de vegetación o ampliando las existentes, y no creando corredores para conectar las manchas ya existentes (SCHULTZ, 1998), además de introducir plantas ricas en néctar y aceites esenciales para favorecer la presencia de esta mariposa (AGUADO et al., 2017). Como medida final se plantea la cría de la especie en cautividad y su posterior introducción en aquellas zonas donde sea escasa su presencia y el hábitat sea el adecuado. La cría en cautividad puede suponer una gran medida para la conservación de esta especie, ya que posee enormes ventajas como; reducidos requerimientos de tiempo y esfuerzo, baja inversión económica, uso de equipos sencillos, además de estimular la conservación de hábitats naturales (GÓMEZ-S., 2006).
Agradecimientos
A mis padres y amigos por el apoyo prestado.
Referencias
AGUADO, L. O., FERERES, A. & VIÑUELA, E., 2017.– Guía de campo de los polinizadores de España: 340 pp. Ediciones Mundi-Prensa, Madrid.
ARAÚJO, M. B. & LUOTO, M., 2007.– The importance of biotic interactions for modelling species distributions under climate change.– Global Ecology and Biogeography, 16(6): 743-753.
ARAÚJO, M. B., PEARSON, R. G., THUILLER, W. & ERHARD, M., 2005.– Validation of species-climate impact models under climate change.– Global Change Biology, 11: 1504-1513.
BOYCE, M. S., VERNIER, P. R., NIELSEN, S. E. & SCHMIEGELOW, F. K. A., 2002.– Evaluating resourceselection functions.– Ecological Modelling, 157(2-3): 281-300.
COLLIN, E., 2003.– Euforgen technical guidelines for genetic conservation and use for European white elm (Ulmus laevis). International Plant Genetic Resources Institute. Rome.
COLLIN, E., BILGER, I., ERIKSSON, G. & TUROK, J., 2000.– The conservation of Elm Genetic Resources in Europe.– The Elms: 281-293.
DE LUIS, M., BRUNETTI, M., GONZÁLEZ-HIDALGO, J. C., LONGARES, L. A. & MARTÍN-VIDE, J., 2010.– Changes in seasonal precipitation in the Iberian Peninsula during 1946-2005.– Global and Planetary Change, 74(1): 27-33.
DENNIS, R. L., 1993.– Butterflies and Climate Change: 276 pp. Manchester University Press, Manchester.
DENNIS, R. L., DAPPORTO, L., DOVER, J. W. & SHREEVE, T. G., 2013.– Corridors and barriers in biodiversity conservation: A novel resource-based habitat perspective for butterflies.– Biodiversity and Conservation, 22:2709-2734.
DENNIS, R. L. H., HODGSON, J. G., GRENYER, R., SHREEVE, T. G. & ROY, D. B., 2004.– Host plants and butterfly biology. Do host-plant strategies drive butterfly status?- Ecological Entomology, 29(1): 12-26.
DIAMOND, S. E., FRAME, A. M., MARTÍN, R. A. & BUCKLEY, L. B., 2011.– Species’ traits predict phenological responses to climate change in butterflies.– Ecology, 92(5): 1005-1012.
DÍAZ, G., GALLEGO, D., GUTIÉRREZ, A., MUSALY, A., SORIANO, E. & GALIÁN, J., 2009.– Caracterización morfológica, fisiológica y molecular de nuevos aislados de Ophiostoma novo-ulmi.– Boletín de Sanidad Vegetal. Plagas, 35: 469-479.
DUNNE, J. P., STOUFFER, R. J. & JOHN, J. G., 2013.– Reductions in labour capacity from heat stress under climate warming.– Nature Climate Change, 3(6): 563-566.
ESRI, 2015.– ArcGIS, version 10.4. Environmental System Research Institute, Redlands, CA.
FIELDING, A. H. & BELL, J. F., 1997.– A review of methods for the assessment of prediction errors in conservation presence/absence models.– Environmental Conservation, 24(1): 38-49.
FORSTER, P. M., ANDREWS, T., GOOD, P., GREGORY, J. M., JACKSON, L. S. & ZELINKA, M., 2013.– Evaluating adjusted forcing and model spread for historical and future scenarios in the CMIP5 generation of climate models.– Journal of Geophysical Research: Atmospheres, 118: 1139-1150.
FOX, R., WARREN, M. S., ROY, D. B., BRERETON, T. M. & ROBINSON, A., 2011.– A new Red List of British butterflies.– Insect Conservation and Diversity, 4: 159-172.
GARCÍA-BARROS, E., MUNGUIRA, M., MARTÍN-CANO, J., ROMO-BENITO, H., GARCÍA-PEREIRA, P. &MARAVALHAS, E. S., 2004.– Atlas de las mariposas diurnas de la Península Ibérica e islas Baleares(Lepidoptera: Papilionoidea & Hesperioidea).– Monografías de la S.E.A., 11: 1-228.
GÓMEZ-S., R., 2006.– Plan de manejo propuesto para la cría de mariposas promisorias como alternativa productiva para comunidades indígenas de la Amazonia colombiana.– Boletín de la Sociedad Entomológica Aragonesa, 38:451-460.
GONZÁLEZ-FERNÁNDEZ, J., 2008.– Algunas citas extemporáneas o poco habituales de ropalóceros de Asturias (Lepidoptera: Papilionoidea & Hesperioidea).– Boletín de la Sociedad Entomológica Aragonesa, 42: 453-454.
HEIKKINEN, R. K., LUOTO, M., LEIKOLA, N., PÖYRY, J., SETTELE, J., KUDRNA, O., MARMION, M., FRONZEK, E. & THUILLER, W., 2010.– Assessing the vulnerability of European butterflies to climate change using multiple criteria.– Biodiversity and Conservation, 19(3): 695-723.
HIJMANS, R. J., CAMERON, S. E., PARRA, J. L., JONES, G. & JARVIS, A., 2005.– Very high resolution, interpolated climate surfaces for global land areas.– International Journal of Climatology, 25: 1965-1978.
IPCC., 2014.– Climate Change 2014: Synthesis Report. Contribution of Working Groups I, II and III to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change: 151 pp. Geneva, Switzerland.
KONVICKA, M., MARADOVA, M., BENES, J., FRIC, Z. & KEPKA, P., 2003.– Uphill shifts in distribution of butterflies in the Czech Republic: Effects of changing climate detected on a regional scale.– Global Ecology and Biogeography, 12(5): 403-410.
LATASSA-ASSO, T., 1999.– Actualización de la distribución geográfica de los lepidópteros ropalóceros de La Rioja(España) (Insecta: Lepidoptera).– ZUBIA. Monográfico, 11: 11-60.
LÓPEZ, C. & PINO, J. J., 1992b.– Confirmación de la presencia de Erebia euryale (Esper, 1805) en Lugo y primeracita para Galicia de Strymonidia w-album (Knoch, 1782).– SHILAP Revista de lepidoterología, 20(80): 405-406.
MAXENT (https://biodiversityinformatics.amnh.org/open_source/maxent/)
MEROW, C., SMITH, M. J. & SILANDER, J. A., 2013.– A practical guide to MaxEnt for modeling species’distributions: what it does, and why inputs and settings matter.– Ecography, 36: 1058-1069.
MILLER, R., 2015.– The Trees and Woodland of Abney Park Cemetery.– The London Naturalist, 87: 1-24.
MIRANDA-SIERRA, C. A., GEADA-LÓPEZ, G. & SOTOLONGO-SOSPEDRA, R., 2017.– Modelación de hábitats potenciales de Pinus caribaea Morelet var. caribaea Barrett y Golfari en el occidente de Cuba.– Avances, 19(1): 42-50.
MORTERA-PIORNO, H., 2007.– Mariposas de Asturias: 241 pp. Gobierno del Principado de Asturias, Oviedo.
MUNGUIRA, M. L., GARCÍA-BARROS, E. & MARTÍN, J., 1997.– Plantas nutricias de los licénidos y satirinos españoles (Lepidoptera?: Lycaenidae y Nymphalidae).– Boletín Asociación Española de Entomología, 21(1-2):29-53.
MURRIA-BELTRÁN, E., 2009.– Presencia de Apatura iris (Linnaeus, 1758) (Nymphalidae, Apaturinae) en el pirineo central de Huesca, nuevos registros de Danaus chrysippus (Linnaeus, 1758) (Nymphalidae, Danainae) del valle medio del Ebro, y otros datos de interés para el conocimiento de los Papilionoidea de Aragón (España) (Lepidoptera).– Boletín de la Sociedad Entomológica Aragonesa, 45: 335-342.
NAVARRO, C. & CASTROVIEJO, S., 2005.– Ulmus L.– Flora Iberica, 3: 245-247 pp. Real Jardín Botánico, CSIC, Madrid.
NEWBOLD, T., GILBERT, F., ZALAT, S., EL-GABBAS, A. & READER, T., 2009.– Climate-based models of spatial patterns of species richness in Egypt ’s butterfly and mammal fauna.– Journal of Biogeography, 36: 2085-2095.
OBREGÓN, R., ARENAS-CASTRO, S., GIL-T, F., JORDANO, D. & FERNÁNDEZ-HAEGER, J., 2014.– Biología, ecología y modelo de distribución de las especies del género Pseudophilotes Beuret, 1958 en Andalucía (Sur de España) (Lepidoptera: Lycaenidae).– SHILAP Revista de lepidoterología, 42(168): 501-515.
PEARCE, J. & FERRIER, S., 2000.– Evaluating the predictive performance of habitat models developed using logistic regression.– Ecological Modelling, 133: 225-245.
PETERSON, A. T. & COHOON, K. P., 1999.– Sensitivity of distributional prediction algorithms to geographic data completeness.– Ecological Modelling, 117(1): 159-164.
PHILIPS, S. J., ANDERSON, R. P. & SCHAPIRE, R. E., 2006.– Maximum entropy modeling of species geographic distributions.– Ecological Modelling, 190: 231-259.
PHILIPS, S. J., DUDIK, M. & SCHAPIRE, R. E., 2004.– A Maximum Entropy Approach to Species Distribution Modeling.– Proceedings of the twenty-first international conference on Machine learning: 83 pp. ACM.
RODRÍGUEZ-CALCERRADA, J., NANOS, N. & ARANDA, I., 2011.– The relevance of seed size in modulating leaf physiology and early plant performance in two tree species.– Trees, 25: 873-884.
ROMO, H., GARCÍA-BARROS, E. & MUNGUIRA, M., 2006.– Distribución potencial de trece especies de mariposas diurnas amenazadas o raras en el área ibero-balear (Lepidoptera: Papilionoidea & Hesperioidea).–Boletín de la Asociación Española de Entomología, 30(3-4): 25-49.
ROMO, H., SANABRIA, P. & GARCÍA-BARROS, E., 2012.– Predicción de los impactos del cambio climático en la distribución de lepidópteros del género Boloria Moore, 1900 en la Península Ibérica (Lepidoptera: Nymphalidae).– SHILAP Revista de lepidoterología, 40(158): 1-20.
ROMO, H. & VELASCO, J. P., 2010.– Selección de áreas prioritarias para las especies de mariposas diurnas amenazadas, endémicas y raras de Asturias (España) (Lepidoptera: Papilionoidea y Hesperioidea).– Boletín de la Sociedad Entomológica Aragonesa, 47: 199-208.
ROMO, H. & GARCÍA-BARROS, E., 2005.– Distribución e intensidad de los estudios faunísticos sobre mariposas diurnas en la Península Ibérica e islas.– Graellsia, 61(1): 37-50.
ROMO, H., MUNGUIRA, M. L. & GARCÍA-BARROS, E., 2007.– Area selection for the conservation of butterflies in the Iberian Peninsula and Balearic Islands.– Animal Biodiversity and Conservation, 30(1): 7-27.
ROSSIGNOLI, A. & GÉNOVA, M., 2003.– Corología y hábitat de Ulmus glabra Huds. en la Península Ibérica.–Ecología, 17: 99-121.
ROY, D. B. & SPARKS, T. H., 2000.– Phenology of British butterflies and climate change.– Global Change Biology, 6(4): 407-416.
RSTUDIO TEAM, 2016.– RStudio: Integrated Development for R. RStudio. Boston, MA: Inc.
SANJURJO-FRANCH, M. J., 2007.– Citas nuevas o interesantes de Papilionoidea Latreille , 1809 (Lepidoptera), en el norte de la provincia de León (España).– Boletín de la Sociedad Entomológica Aragonesa, 40: 555-558.
SCHULTZ, C. B., 1998.– Dispersal Behavior and Its Implications for Reserve Design in a Rare Oregon Butterfly.–Conservation Biology, 12(2): 284-292.
SOLLA, A. & GIL, L., 2001.– Selección de olmos resistentes a la grafiosis. I. Influencia de la composición del inóculo efectivo.– Boletín de Sanidad Vegetal. Plagas, 27: 355-362.
SOMOT, S., SEVAULT, F., DÉQUÉ, M. & CRÉPON, M., 2008.– 21st century climate change scenario for the Mediterranean using a coupled atmosphere-ocean regional climate model.– Global and Planetary Change, 63:112-126.
STEINBAUER, M. J., GRYTNES, J.A., JURASINSKI, G., KULONEN, A., LENOIR, J., PAULI, H., RIXEN, C., WINKLER, M., BARDY-DURCHHALTER, M., BARNI, E., BJORKMAN, A. D., BREINER, F. T., BURG, S., CZORTEK, P., DAWES, M. A., DELIMAT, A., DULLINGER, S., ERSCHBAMER, B., FELDE, V. A., FERNÁNDEZ-ARBERAS, O., FOSSHEIM, K. F., GÓMEZ-GARCÍA, D., GEORGES, D., GRINDRUD, E., HAIDER, S., HAUGUM, S. V., HENRISKSEN, H., HERREROS, M. J., JAROSZEWICZ, B., JAROSZYNSKA, F., KANKA, R., KAPFER, J., KLANDERUD, K., KÜHN, I., LAMPRECHT, A., MATTEODO, M., MORRA DI CELLA, U., NORMAND, S., ODLAND, A., OLSEN, S. L., PALACIO, S., PETE, M., PISCOVÁ, V., SEDLAKOVA, B., STEINBAUER, K., STÖCKLI, V., SVENNING, J., TEPPA, G., THEURILLAT, J., VITTOZ, P., WOODIN, S. J., ZIMMERMANN, N. E., WIPF, S., 2018.– Accelerated increase in plant species richness on mountain summits is linked to warming.– Nature, 556: 231-234.
TEMPLADO, J., 1983.– El paisaje vegetal y la distribución de los Lepidópteros Ibéricos (Lepidoptera).– Boletín de la Asociación Española de Entomología, 6: 337-341.
THOMAS, J. A., SIMCOX, D. J. & HOVESTADT, T., 2011.– Evidence based conservation of butterflies.– Journal of Insect Conservation, 15(1): 241-258.
TOLMAN, T. & LEWINGTON, R., 2008.– The most complete guide to the butterflies of Britain and Europe: 384 pp. Fluke Art, London.
UVAROV, B. P., 1931.– Insects and climate.– Transactions of the Entomological Society of London, 79(27): 174-186.
VENTURAS, M., FUENTES-UTRILLA, P., ENNOS, R., COLLADA, C. & GIL, L., 2013.– Human-induced changes on fine-scale genetic structure in Ulmus laevis Pallas wetland forests at its SW distribution limit.– Plant Ecology, 214: 317-327.
VENTURAS, M., LÓPEZ, R., GASCÓ, A. & GIL, L., 2013.– Hydraulic properties of European elms: xylem safetyefficiency tradeoff and species distribution in the Iberian Peninsula.– Trees, 27: 1691-1701.
VISSER, M. E. & BOTH, C., 2005.– Shifts in phenology due to global climate change: the need for a yardstick.– Proceedings of the Royal Society B: Biological Sciences, 272: 2561-2569.
WALDHARDT, R., SIMMERING, D. & OTTE, A., 2004.– Estimation and prediction of plant species richness in a mosaic landscape.– Landscape Ecology, 19: 211-226.
WILSON, R. J., GUTIÉRREZ, D., GUTIÉRREZ, J. & MONSERRAT, V. J., 2007.– An elevational shift in butterfly species richness and composition accompanying recent climate change.– Global Change Biology, 13(9): 1873-1887.
YUKIMOTO, S., ADACHI, Y., HOSAKA, M., SAKAMI, T., YOSHIMURA, H., HIRABARA, M., TANAKA, T.,SHINDO, E., TSUJINO, H., DEUSHI, M., MIZUTA, R., YABU, S., OBATA, A., NAKANO, H., KOSHIRO,T., OSE, T., KITOH, A., 2012.– A New Global Climate Model of the Meteorological Research Institute: MRICGCM3(Model Description and Basic Performance).– Journal of the Meteorological Society of Japan, 90A:23-62.