

Larvas y plantas nutricias de Lepidoptera en fragmentos de bosque seco tropical del departamento de Sucre, Colombia (Insecta: Lepidoptera)
Caterpillars and host plants of Lepidoptera from dry tropical forest fragments in Sucre, Colombia (Insecta: Lepidoptera)
Larvas y plantas nutricias de Lepidoptera en fragmentos de bosque seco tropical del departamento de Sucre, Colombia (Insecta: Lepidoptera)
SHILAP Revista de Lepidopterología, vol. 47, núm. 185, 2019
Sociedad Hispano-Luso-Americana de Lepidopterología
Recepción: 08 Febrero 2018
Aprobación: 10 Abril 2018
Publicación: 30 Marzo 2019
Resumen: Se evaluó la diversidad de larvas (Lepidoptera) en tres fragmentos de bosque seco del departamento de Sucre, norte de Colombia y se registran sus plantas nutricias. Se instalaron dos transectos lineales de 500 metros por localidad, uno en el borde y el otro al interior del bosque. Las orugas se recolectaron mediante batido y revisión de la vegetación. Se recolectaron 608 larvas en 14 familias y 47 especies de Lepidoptera asociadas a 27 familias de plantas angiospermas. Las familias mejor representadas fueron: Saturniidae con 7 especies (52 individuos), seguido de Nymphalidae con 6 especies (12 indivíduos) y Erebidae con 5 especies (358 individuos), con una especie cada una. Las familias menos abundantes son Lycaenidae (12 individuos) y Pyralidae (2 individuos). Al borde del bosque se recolectó el mayor número de especies e individuos (34 especies y 373 larvas). Las plantas con mayor número de larvas asociadas son Moraceae y Bignoniaceae. Los perfiles de diversidad no mostraron diferencias en la diversidad de las zonas muestreadas lo que se puede atribuir a la proximidad física de los fragmentos.
Palabras clave: Insecta, Lepidoptera, fitófagos, diversidad, solución pampel, técnica de inflación, Colombia.
Abstract: We analyzed the diversity of caterpillars (Lepidoptera) associated with plants of three dry tropical forest fragments in three localities of Sucre, North of Colombia. Two linear transects of 500 meters were installed per locality, one at the edge and the other inside the fragment. The caterpillars were collected by shaking and vegetation review. 608 larvae belonging to 14 families and 47 species of Lepidoptera, and 27 families of angiosperms were collected. Families best represented were; Saturniidae with 7 species (52 individuals), followed by Nymphalidae with 6 species (12 individuals) and Erebidae with 5 species (358 individuals). Less abundant families were Lycaenidae (12 individuals) and Pyralidae (2 individuals), with 1 species each. At the edge of the forest the largest number of species and individuals were collected (34 species and 373 larvae). The plants with the highest number of associated larvae were Moraceae and Bignoniaceae. The diversity profiles showed no difference among the sampled areas, which can be attributed to the physical proximity of the fragments.
Keywords: Insecta, Lepidoptera, phytophagous, species diversity, pampel solution, inflation technique, Colombia.
Introduction
Las larvas de Lepidoptera representan un componente importante en los ecosistemas. Estas formas de vida toman un papel funcional como herbívoros y transformadores de grandes cantidades de biomasa vegetal (URRETABIZKAYA et al., 2010; TIPLE et al., 2011). Además, son un elemento importante en la cadena alimenticia ya que representan el recurso alimenticio de diferentes grupos insectívoros y son nutricias de una amplia variedad de parasitoides.
Aunque poco se conoce de la biología y estados inmaduros de muchas especies en Lepidoptera, se acepta la gran representatividad de especies en el Neotrópico. Se reconocen cerca de 157.424 especies, distribuidas en 43 subfamilias y 133 familias (MITTER et al., 2017).
Generalmente la alta diversificación del grupo está asociada a sus hábitos alimenticios, pero el proceso y los mecanismos que han conducido a esta diversificación son poco entendidos (BRABY & TRUEMAN, 2006). Más del 99% de las especies son fitófagas, sus estados inmaduros explotan una amplia variedad de plantas con semillas. Esta capacidad se encuentra relacionada con la diversidad taxonómica de sus plantas nutricias (PIERCE, 1995; DYER et al., 2007). Sin embargo, poco se conoce de la especificidad de las plantas nutricias de Lepidoptera en ambientes tropicales (TIPLE et al., 2011); donde los ecosistemas como el bosque seco tropical representan un hábitat importante para las poblaciones.
En Colombia se estima que sólo el 3% de los bosques secos están incluidos en áreas protegidas. Actualmente este bioma es uno de los más amenazados y también menos estudiado (GALVÁN-GUEVARA et al., 2015). Este ecosistema anualmente pierde su cobertura por la rápida transformación de paisajes intactos a paisajes fragmentados por actividades como la agricultura tradicional y la ganadería extensiva, que representan la principal amenaza para la biodiversidad, ocasionando pérdida potencial de hábitat para un número elevado de especies (MURILLORAMOS et al., 2016). En la región del Caribe colombiana se concentran los relictos de bosque en mejor estado de conservación (GALVÁN-GUEVARA et al., 2015); y los montes de María representa una de las mayores extensiones del bosque. Estas extensiones de bosque se encuentran entre los departamentos de Sucre y Bolívar. Muchos de los remanentes de bosque ubicados en estos departamentos no solo enfrentan problemas de conservación, también de investigación. Dada la carencia de información de diferentes grupos de invertebrados asociados al bosque seco, un bioma en estado de vulnerabilidad. El objetivo de esta investigación fue estimar la diversidad de larvas de Lepidoptera asociadas a plantas de bosque seco tropical en el departamento de Sucre, costa Caribe colombiana y aportar al conocimiento de las plantas nutricias de diferentes grupos de Lepidoptera.
Materiales y métodos
Área de estudio: El estudio se realizó en tres veredas del municipio de Colosó, departamento de Sucre-Colombia (Figura 1, Tabla. 1). Esta zona se caracteriza por preservar la mayor parte de bosque seco de Sucre. Las formaciones de bosque comprenden entre 40-45% del área total del municipio. Estas formaciones boscosas se caracterizan por presentar franjas de colinas a partir de 0-1000 m, precipitación de 896 a 1233 mm anual, temperatura entre 25-28º C y humedad relativa de 83.5% (GARCÍA et al., 2016).

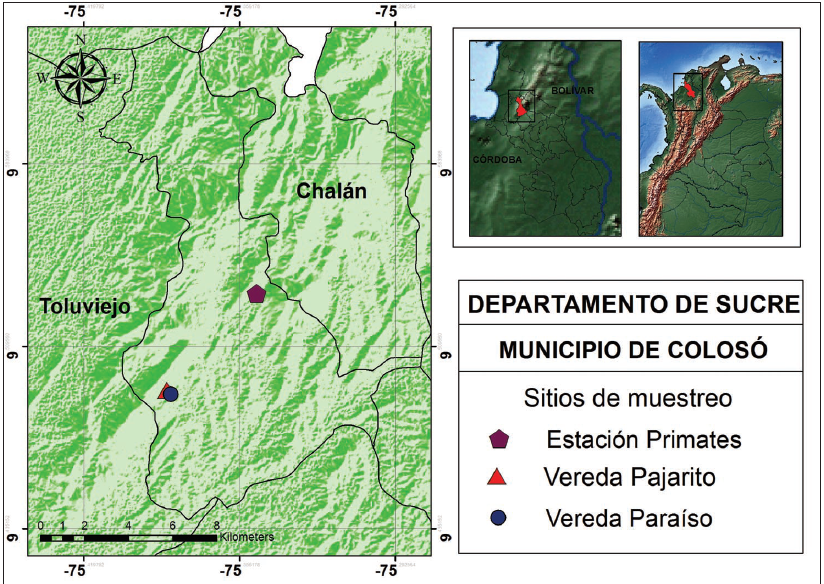
MUESTREOS
La fase en campo se desarrolló durante los meses de junio y julio de 2016, meses que corresponden a la época de lluvias. Se instalaron dos transectos lineales de 500 metros, orientados paralelamente uno al borde y el otro al interior de cada fragmento de bosque. El recorrido dentro de los transectos fue en forma de Zigzag revisando la vegetación en un esfuerzo de ocho horas por transecto (08:00-12:00 y 14:00-18:00), cuatro días por localidad.
Las larvas se recolectaron por batido de la vegetación en periodos controlados de tiempo y a través de búsqueda directa sobre la planta (MÁRQUEZ-LUNA, 2005). Los organismos se capturaron con pinzas entomológicas y se almacenaron en bolsas Ziploc previamente rotuladas para su trasporte al laboratorio. El material vegetal se recolectó utilizando una desjarretadera o podadora dependiendo de la forma de crecimiento de las plantas. Las muestras se prensaron para posterior tratamiento en laboratorio. Se tomaron datos de morfología y registro fotográfico de larvas y sus plantas nutricias con cámara NIKON, modelo COOLPIX P510.
Las larvas se preservaron en solución Pampel durante 24 horas (BARRIENTOS, 2004). Parte del material preservado se montó en alfileres entomológicos aplicando la técnica de inflación (SCUDDER, 1874). Este método consistió en la extracción del contenido interno del organismo por medio de una pequeña incisión en la abertura anal, utilizando jeringas. Posteriormente las muestras se exponen al calor hasta endurecer totalmente su cutícula. El material se encuentra depositado en el Museo deZoología de la Universidad de Sucre, Colombia (Figura 2).

IDENTIFICACIÓN TAXONÓMICA
Para las orugas se emplearon diferentes fuentes de información (COTO, 1997; CAPINERA, 2001; GARCÍA et al., 2002; CHACÓN et al., 2007; SPECHT et al., 2006; PAREDES et al., 2010; URRETABIZKAYA et al., 2010). Así como páginas web; Parasitoid-Caterpillar-Plant Interactions in the Americas (www.caterpillars.myspecies.info/), BugGuide (www.bugguide.net/node/view/57/tree), UK Butterflies (www.ukbutterflies.co.uk/index.php), Butterflies and Moths of North America (www.butterfliesandmoths.org/), Área de Conservación Guanacastes (www.acguanacaste.ac.cr), Base-Butterfly Caterpillars(www.pbase.com/tmurray74/butterfly_caterpillars), The Life Cycle of Butterflies and Moths (Lepidoptera) (www.ukleps.org/morphology.html).
La determinación taxonómica del material vegetal se hizo a través de las claves (GENTRIE, 1993) hasta el nivel genérico, corroborando las especies por medio de la colección del herbario de la Universidad Nacional de Colombia (www.biovirtual.unal.edu.co/es/colecciones/search/plants/), para registros de plantas en Bosque Seco Tropical.
ANÁLISIS DE DATOS
Se evaluó la cobertura de la muestra para cada fragmento de bosque seco como una medida de la completitud del muestreo. Cuando los ambientes a comparar registran niveles de cobertura cercanos a 1 es viable realizar comparaciones directas de su diversidad (MURILLO-RAMOS et al., 2016). Para comparar la diversidad alfa de los fragmentos, se generaron perfiles de diversidad, que representan de manera gráfica la diversidad en función de una familia paramétrica de diversidad. (TÓTHMÉRÉSZ, 1995). Los perfiles se generaron usando las diversidades de orden “q”, también llamada “diversidad verdadera”. La diversidad de orden cero (q=0) es insensible a la frecuencia de las especies, por lo que les da igual peso a las especies raras que al resto de las especies, correspondiendo a la riqueza de especies. La diversidad de orden uno (q=1) usa las frecuencias de las especies tal como son recolectadas en campo. La diversidad calculada de esta forma no favorece ni a las especies raras ni a las abundantes y se conoce como el exponencial de la entropía de Shannon. Finalmente, la diversidad de orden dos (q=2) le da mayor peso a las especies dominantes de la comunidad, corresponde al inverso de la concentración de Simpson. Estas medidas permiten evaluar de forma comparativa cambios en la diversidad de las comunidades. El cálculo de la cobertura de la muestra y la estimación de los órdenes de la diversidad se hicieron con el paquete iNterpolation and EXTrapolation – iNEXT (CHAO & JOST, 2012) integrado al programa estadístico R (v3.1.3) (R CoreTeam 2014). Se usaron las curvas de rango-abundancia (WHITTAKER, 1965) para comparar la estructura de la comunidad entre los fragmentos de bosque seco. Estas curvas son útiles porque permiten comparar la composición, abundancia y la uniformidad entre las comunidades (MURILLO-RAMOS et al., 2016). La diversidad beta verdadera se calculó para analizar la variación en la composición de especies entre hábitats, empleando la partición multiplicativa de gamma (βD= γD / αD) (JOST, 2007). La diversidad beta representa el número efectivo de comunidades en una región y puede variar desde uno hasta el número de comunidades que se están comparando. Los cálculos se realizaron con el programa estadístico R (v3.1.3) (R CORETEAM, 2014).
Resultados
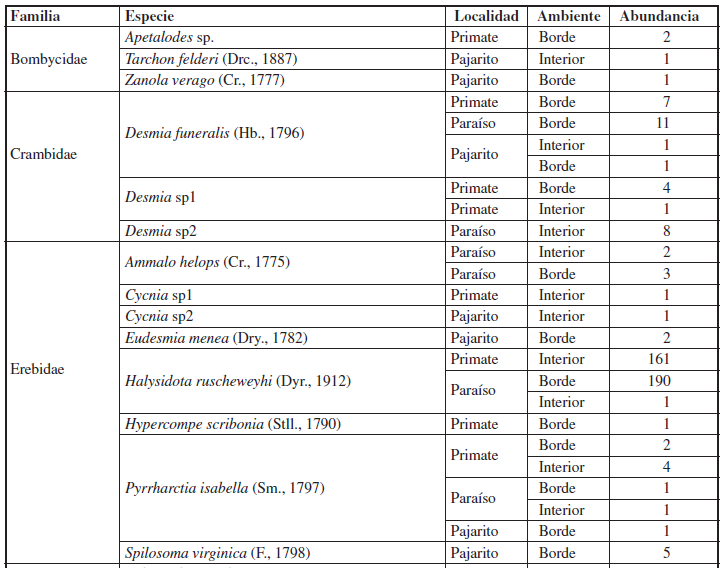
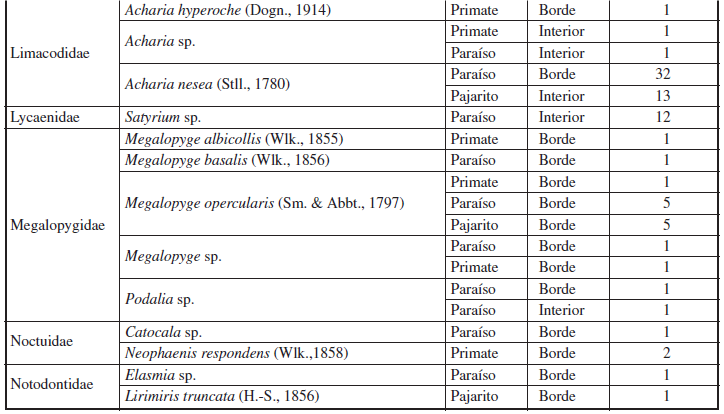
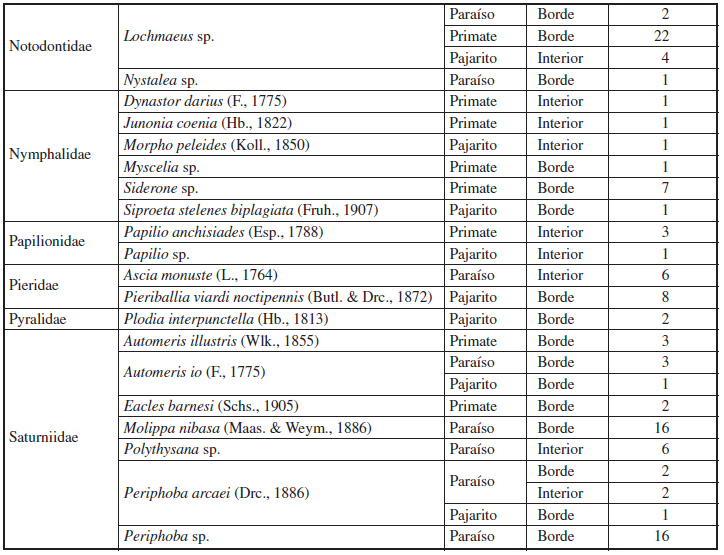
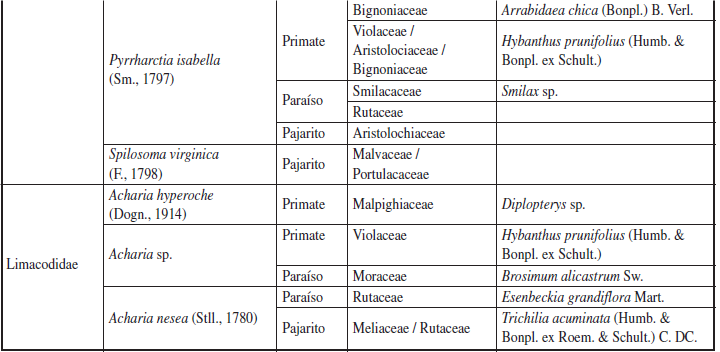
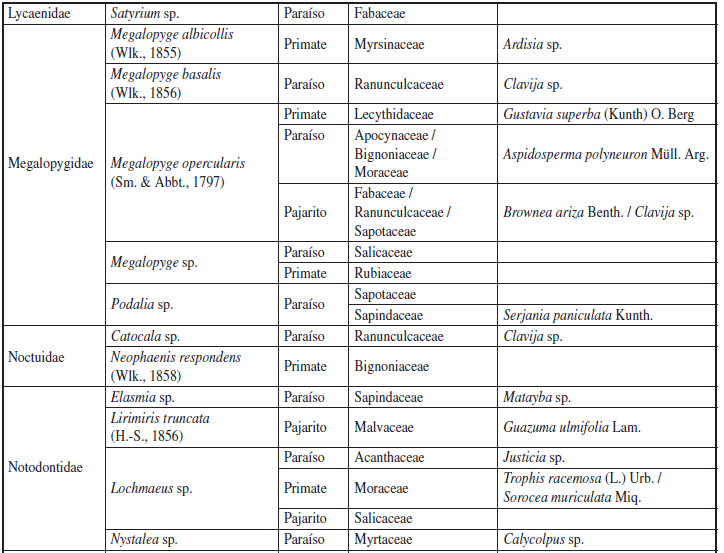
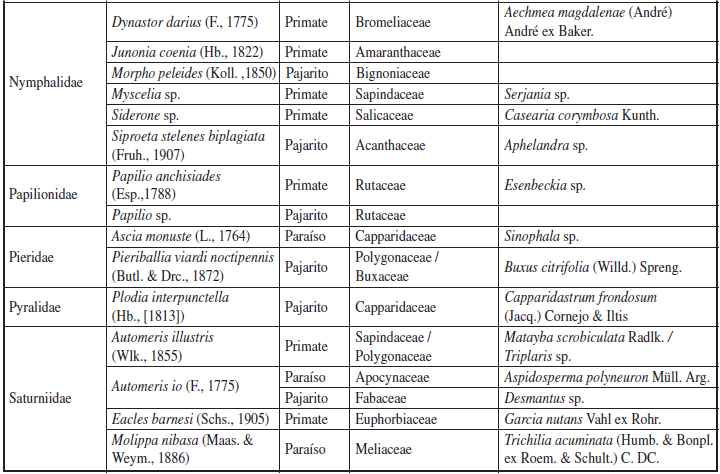
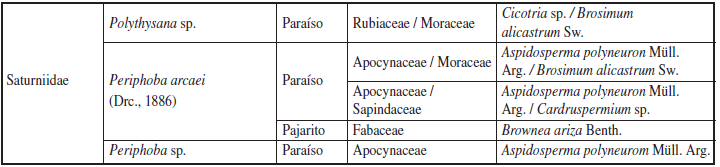
Se recolectaron 608 larvas pertenecientes a 13 familias, 37 géneros y 47 especies de Lepidoptera (Anexo 1). Estas especies de larvas estuvieron asociadas a 27 familias de plantas angiospermas (Figuras 6-10). Las familias de larvas mejor representadas fueron: Erebidae con 8 especies (376 individuos), Saturniidae con 7 especies (52 individuos) y Nymphalidae con 6 especies (12 individuos).
Las familias menos representativas fueron: Lycaenidae con 1 especie (12 individuos) y Pyralidae con 1 especie (2 individuos). La localidad con mayor abundancia y riqueza de especies fue la vereda Paraíso con 327 larvas, representadas en 10 familias, 18 géneros y 26 especies equivalentes al 53.8% del total. Seguida por la estación Primates con 230 larvas, 11 familias, 17 géneros y 21 especies equivalentes al 37.8 %. La localidad con menor riqueza y abundancia fue la vereda Pajarito con 51 larvas, 12 familias, 18 géneros y 19 especies equivalentes al 8.4% del total.
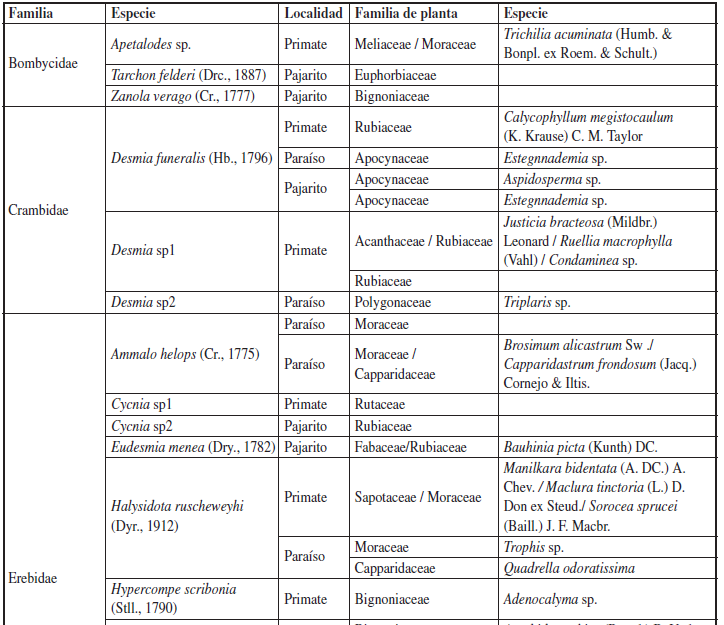
En el borde del bosque se registra la mayor abundancia y la riqueza, 373 larvas y 34 especies (61.35%), representadas en 12 familias y 27 géneros, por lo contrario, al interior solo se recolectaron 235 larvas (38.65%), representadas en 12 familias y 17 géneros y 22 especies. En común se registran para las tres localidades familias como; Crambidae, Erebidae, Limacodidae, Megalopygidae, Notodontidae y Saturniidae. Exclusivamente se reportó Lycaenidae para la vereda Paraíso y Pyralidae para la vereda Pajarito. Localidades como; estación Primates y vereda Pajarito comparten familias como Bombycidae, Nymphalidae y Papilionidae. Mientras que estación Primates y vereda Paraíso comparten la familia Noctuidae, y las veredas Paraíso y Pajarito comparten la familia Pieridae. Plantas de las familias Moraceae, Bignoniaceae, Rubiaceae, Rutaceae y Bromeliacea parecen ser las nutricias más importantes en el área de estudio. Siendo Moraceae la familia de plantas con más especies de larvas asociadas, seguida de Bignoniaceae. Otras familias de plantas utilizadas como nutricias se muestran en el Anexo IIhosped. Las especies con mayor registro de plantas nutricias son Megalopyge opercularis (Megalopygidae) y Pyrrharctia isabella (Erebidae). Estas especies se recolectaron en más de cinco plantas nutricias diferentes.
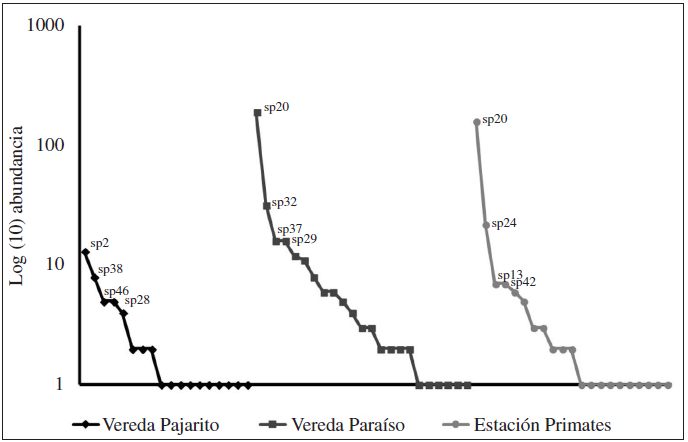
El cálculo del análisis de completitud por el método de la cobertura de la muestra reveló que en los fragmentos de bosque seco se obtuvo una completitud mayor al 80%. El porcentaje de completitud obtenido para cada localidad fue 98% para la vereda Paraíso, 96% para la estación Primates y 80% para la vereda Pajarito. Las curvas en la gráfica rango-abundancia, indican una tendencia levemente diferente entre los fragmentos de bosque seco tropical. La vereda Pajarito presenta una pendiente menos pronunciada en cuanto a la distribución de abundancias. De forma común la especie dominante en la vereda Paraíso y estación Primates fue: sp20; Halysidota ruscheweyhi la cual concentra 58% y 70% respectivamente de los individuos recolectados. En el fragmento de bosque seco de la vereda pajarito la especie dominante fue: sp2; Acharia nesea la cual concentra el 25% de los individuos (Figura 3).
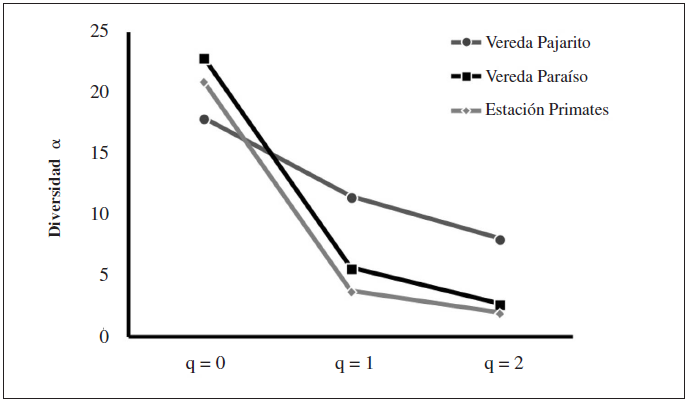
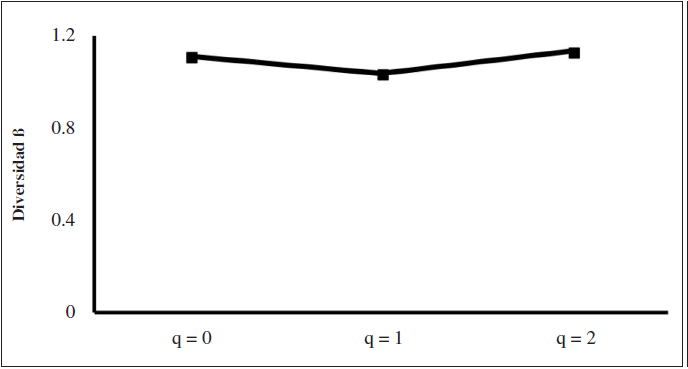
El análisis de diversidad alfa no muestra una clara diferencia en la diversidad en las zonas muestreadas. Sin embargo, las pendientes son diferentes en las especies abundantes y dominantes de cada localidad (Figura 4). La diversidad beta fue baja, varió entre 1.038 y 1.135 (beta máxima de 3) por lo que no se observa una clara diferencia entre los ensambles de cada sitio (Figura 5).





Discusión
La riqueza de especies en este estudio representa el 1.5% del inventario nacional (ANDRADE et al., 2007) y el 16.8% de especies reportadas por DOMÍNGUEZ et al. (2011) para el departamento de Sucre. De las especies registradas, once son nuevos reportes de ropalóceros para el bosque seco de Sucre. Para la familia Nymphalidae se reportan 6 especies (Dynastor darius, Junonia coenia, Morpho peleides, Myscelia sp., Siderone sp. y Siproeta stelenes biplagiata ), Papilionidae 2 especies (Papilio anchisiades y Papilio sp.), Lycaenidae con 1 especie (Satyrium sp.) y Pieridae con 2 especie (Ascia monuste, Pieribalia viardi noctipennis). Mientras que 36 especies son nuevos registros para Heterocera de Sucre.
Entre las familias con mayor riqueza de especies reportadas se encuentra Erebidae, Nymphalidae y Saturniidae, esto coincide con los resultados encontrados por VARGAS-ZAPATA et al. (2011) y DOMÍNGUEZ et al. (2011) para bosque el seco. Esta riqueza de especies se debe a que Erebidae y Nymphalidae son en general una familia muy diversa, y sus especies tienden a explorar una amplia variedad de recursos en el bosque. Las especies de la familia Saturniidae parecen estar fácilmente adaptadas a las características ambientales de zonas bajas y por lo general colonizan una amplia variedad de hábitats (MUÑOZ et al., 2010). Lycaenidae y Pyralidae fueron las familias menos representativas en las zonas de estudio, estos resultados se pueden atribuir a la no coincidencia del tiempo de desarrollo larval con el tiempo de recolección o por no coincidir con sus plantas nutricias
En general la riqueza y abundancia de las larvas fue mayor en el borde (61.35%) comparado al interior del bosque. Esto obedece al grado de luz que mayormente reciben estas áreas, lo que condiciona la presencia de flores para que liben los adultos y el desarrollo de las plantas nutricias para la alimentación de las larvas (DOMÍNGUEZ et al., 2011). Las curvas de rango-abundancia mostraron que el ensamble de larvas de la vereda Paraíso y estación Primates fueron más uniformes que el ensamble del fragmento de la vereda Pajarito. Este resultado se debe a que en estas localidades la especie Halysidota ruscheweyhi dominó la abundancia para estos ambientes. Esta abundancia está asociadas a la presencia de plantas nutricias de la familia Moraceae y Myrtaceae (TAVARES et al., 2014), sin embargo, nuestros resultados señalan que esta larva no solo se asocia con especies de la familia Moraceae, sino también con especies de las familias Sapotaceae, Dilleniaceae y Capparidaceae lo que favorece su supervivencia.
El análisis de diversidad mostró que no hay diferencias en la diversidad de larvas de los fragmentos de bosque seco muestreados. Esto puede obedecer a la proximidad física de los fragmentos, a la homogeneidad de la vegetación o porque las especies recolectadas tienen amplia movilidad y distribución. El perfil de diversidad beta fue bajo, sugiriendo poca variabilidad en la composición de especies, lo que indica que las especies encontradas en los fragmentos conforman una misma omunidad. Esto se puede explicar por la cercanía de los ambientes muestreados y porque estos fragmentos podrían ser elementos derivados de la transformación de los grandes bosques de Sucre, lo que explica la alta similitud taxonómica de los ensambles en las localidades de estudio.
De las relaciones de larvas con plantas nutricias en el estudio, la familia Papilionidae mostró una estrecha relación con plantas de la familia Rutaceae. Estos resultados coninciden con lo reportado por TIPLE et al. (2011) quien indica además asociaciones entre familias como; Pieridae con Capparidaceae, Nymphalidae con Acanthaceae y Lycaenidae con Fabaceae en formaciones de bosque seco tropical. Por su parte GARCÍA et al. (2002), hace las mismas indicaciones para Lepidoptera en Colombia, aportando además familias como Bignoniaceae asociado al género Morpho, Bromeliaceae asociado a la especie Dynastor darius y Sapindaceae relacionada con la familia Nymphalidae, concordando con los registros de nuestro estudio.
Bignoniaceae y Rubiaceae mantuvieron la mayor riqueza y abundancia de larvas. Estas plantas representan el segundo y tercer lugar respectivamente en mayor riqueza de especies en el bosque seco tropical (IAVH, 1998) por lo que se puede inferir que estas familias de plantas nutricias son importantes para las larvas en las zonas de estudio.
A manera de recomendación las estrategias reproductivas entre las especies de Lepidoptera son variables en cuanto al número de generaciones que producen cada año siendo univoltinas (una generación), bivoltinas (dos generaciones) y multivoltinas (varias generaciones), lo que indica una alta posibilidad durante el muestreo de no coincidir con la presencia de algunas especies. Lo que se esperaría que al realizar muestreos a futuros a lo largo del año se pueda tener una información más completa de las especies en el bosque seco.
Agradecimientos
Especialmente a: Iriseth Ricardo Molina, Ema Montes Arcia, Eloisa Amell Amell, Carlos Taboada Verona, Oscar Sierra-Serrano por sus acompañamientos y apoyo al pre-muestreo y muestreo del estudio.
Referencias
ANDRADE-C., M. G., HENAO-BAÑOL, E. R. & TRIVIÑO, P., 2013.– Técnicas y procesamiento para la recolección, preservación y montaje de mariposas en estudios de biodiversidad y conservación (Lepidoptera: Hesperioidea-Papilionoidea).– Revista de la Academia Colombiana de Ciencias, 37(144): 311-325.
BRABY, M. F. & TRUEMAN, J. W. H., 2006.– Evolution of larval host plant associations and adaptive radiation in pierid butterflies.– Journal of Evolutionary Biology, 19(5): 1677-1690.
BOOM, C., SEÑA, L., VARGAS, M. A. & MARTÍNEZ, N., 2013.– Mariposas Hesperioidea y Papilionoidea (Insecta: Lepidoptera) en un fragmento de bosque seco tropical, Atlántico, Colombia.– Boletín Cientifico del Museo de Historia Natural, 17(1): 149-167.
CAPINERA, J. L., 2001.– Order Lepidoptera-Caterpillars, Moths and Butterflies. Pp: 353-510.– In J. L. CAPINERA. Handbook of Vegetable Pests: 800 pp. Academic Press. San Diego, California.
COTO, D., 1997.– Lepidoptera en cultivos anuales y perennes.– Manual de reconocimiento. Centro Agronómico Tropical de Investigación y Enseñanza: 84 pp. CATIE, serie técnica. Turrialba, Costa Rica.
CHAO, C. & JOST, L., 2012.– Coverage-based rarefaction and extrapolation: standardizing samples by completeness rather than size.– Ecology, 9: 2533-2547.
CHACÓN, I. A. & MONTERO, J. J., 2007.– Mariposas de Costa Rica / Butterflies and moths of Costa Rica: 624 pp. Editorial Instituto Nacional de Biodiversidad, INBio. Santo Domingo, Heredia.
DYER, L. A., SINGER, M. S., LILL, J. T., STIREMAN, J. O., GENTRY, G. L., MARQUIS, R. L., RICKLEFS, R. E., GREENEY, H. F., WAGNER, D. L., MORAIS, H. C., DINIZ, I. R., KURSAR, T. A. & COLEY, P. D., 2007.– Host specificity of Lepidoptera in tropical and temperate forests.– Nature, 448(9): 696-700.
GALVÁN-GUEVARA, S., BALLUT-DAJUD, G. & DE LA OSSA-V., J., 2015.– Determinación de la fragmentación del bosque seco del arroyo Pechelín, Montes de María, Caribe, Colombia.– Biota Colombiana, 16(2): 149-157.
GARCÍA, C., CONSTANTINO, L., DOLORES, M. & KATTAN, G., 2002.– Guía de campo: Mariposas Comunes de la Cordillera Central de Colombia: 105 pp. Wild Life Conservation Society Colombia, Bogotá D. C.
GARCÍA-M., S., BASILIO-B., H., HERAZO-V., F., MERCADO-G., J. & MORALES-P., M., 2016.– Diversidad de briófitos en los Montes de María, Colosó (Sucre, Colombia).– Colombia Forestal, 19(1): 41-52.
INSTITUTO ALEXANDER VON HUMBOLDT, IAVH., 1998.– El bosque seco tropical (Bs-t) en Colombia. Programa del Inventario de la Biodiversidad: 24 pp. Grupo de Exploraciones y Monitoreo Ambiental GEMA. Bogota D.C.
JOST, L., 2007.– Partitioning diversity into independent alpha and beta components.– Ecology, 88: 2427-2439.
MÁRQUEZ-LUNA, J., 2005.– Técnicas de colecta y preservación de insectos. Centro de Investigaciones Biológicas. Universidad Autónoma del Estado de Hidalgo-México.– Boletín Sociedad Entomológica Aragonesa, 37: 385-408.
MITTER, C., DAVIS, D. R. & CUMMINGS, M. P., 2017.– Phylogeny and Evolution of Lepidoptera.– Annual Reviwe of Entomology, 62: 265-283.
MONTERO, F., MORENO, M. & GUTIÉRREZ, L. C., 2009.– Mariposas (Lepidoptera: Hesperioidea y Papilionoidea) asociadas a fragmentos de bosque seco en el departamento del Atlántico, Colombia.– Boletín Científico del Centro de Museos. Museo de Historia Natural, 13(2): 157-173.
MURILLO-RAMOS, L., AYAZO, R. & MEDINA, C., 2016.– Diversidad de escarabajos coprófagos (Coleoptera: Scarabaeinae) en un remanente ribereño y un fragmento de bosque húmedo tropical en Córdoba. Colombia.–Ecología Austral, 26: 17-26.
MUÑOZ, A. & AMARILLO-SUÁREZ, A., 2010.– Variación altitudinal en diversidad de Arctiidae y Saturniidae (Lepidoptera) en bosque de niebla Colombia.– Revista Colombiana de Entomología, 36(2): 292-299.
PAREDES, J., PERALTA, E. & CHONG, P., 2010.– Brote de Eacles imperialis (Lepidoptera: Saturniidae) en cultivos de cacao y frutales en Milagro-Ecuador.– Revista Tecnológica ESPOL, 23(1): 13-19.
PIERCE, N. E., 1995.– Predatory and Parasitic Lepidoptera: Carnivores Living on Plants. Massachusetts- USA.– Journal of the Lepidopterists Society, 49(4): 412-453.
R CORE TEAM, 2014.– R: A language and environment for statistical computing. R Foundation for Statistical Computing. Available from http://www.R-project.org.
SCUDDER, S. H., 1874.– The Preservation of Caterpillars by Inflation.– The American Society of Naturalist, 8(6): 321-326.
SPECHT, A., FORMENTINI, A. & CORSEUIL, E., 2006.– Biología de Automeris illustris (Walker) (Lepidoptera, Saturniidae, Hemileucinae).– Revista Brasileira de Zoologia, 23(2): 537-546.
TIPLE, A. D., KHURAD, A. M. & DENNIS, R. L., 2011.– Butterfly larval host plant use in a tropical urban context: Life history associations, herbivory, and landscape factors.– Journal of Insect Science, 11: 65. doi: 10.1673/031.011.6501.
TÓTHMÉRÉSZ, B., 1995.– Comparison of different methods for diversity ordering.– Journal Vegetal Science, 6: 283-290.
URRETABIZKAYA, N., VASICEK, A. & SAINI, E., 2010.– Insectos perjudiciales de importancia agronómica: I. Lepidópteros: 77 pp. Instituto Nacional de Tecnología Agropecuaria, INTA. Buenos Aires.
VARGAS-ZAPATA, M., MARTÍNEZ-HERNÁNDEZ, N., GUTIÉRREZ-MORENO, L., PRINCE-CHACÓN, S., HERRERA-COLÓN, V. & TORRES-PERIÑÁN, L., 2011.– Riqueza y abundancia de Hesperioidea y Papilionoidea (Lepidoptera) en la reserva natural Jardín de las Delicias, Santa Marta, Magdalena, Colombia.– Acta Biológica Colombiana, 16(1): 43-60.
WHITTAKER, R. H., 1965.– Dominance and diversity in land plant communities.– Science, 147: 250-260
Anexo 1
Anexo 2
Notas de autor
leidys.murillo@unisucre.edu.co