

Estados inmaturos de Lepidoptera (LIII). Tres especies del género Ancylosis Zeller, 1839 en Huelva, España (Lepidoptera: Pyralidae, Phycitinae)
Immature stages of Lepidoptera (LIII). Three species of the genus Ancylosis Zeller, 1839, in Huelva, Spain (Lepidoptera: Pyralidae, Phycitinae)
Estados inmaturos de Lepidoptera (LIII). Tres especies del género Ancylosis Zeller, 1839 en Huelva, España (Lepidoptera: Pyralidae, Phycitinae)
SHILAP Revista de lepidopterología, vol. 44, núm. 176, 2016
Sociedad Hispano-Luso-Americana de Lepidopterología
Recepción: 05 Mayo 2015
Aprobación: 01 Junio 2015
Publicación: 30 Diciembre 2016
Resumen: Se describen e ilustran los estados inmaturos de tres especies del género Ancylosis Zeller, 1839: Ancylosis .Ancy- losis. cinnamomella (Duponchel, 1836); Ancylosis .Cabotia. oblitella (Zeller, 1848) y Ancylosis .Syria. arenosella (Staudinger, 1859), que vuelan en Huelva (España), así como su ciclo biológico, sus plantas nutricias y la distribución.
Palabras clave: Lepidoptera, Pyralidae, Phycitinae, Ancylosis, Cabotia, Syria, estados inmaturos, Huelva, España.
Abstract: The immature stages of three species of genus Ancylosis Zeller, 1839: Ancylosis .Ancylosis. cinnamomella (Duponchel, 1836); Ancylosis .Cabotia. oblitella (Zeller, 1848) and Ancylosis .Syria. arenosella (Staudinger, 1859), that fly in Huelva (Spain) are described and illustrated, as well as their biological cycle, food plants and distribution.
Keywords: Lepidoptera, Pyralidae, Phycitinae, Ancylosis, Cabotia, Syria, immature stages, Huelva, Spain.
Introducción
El género Ancylosis Zeller, 1839, es muy complejo, con numerosas sinonimias, pasando algunas de ellas a subgénero, como Heterographis Ragonot, 1885, Cabotia Ragonot, 1888 y Syria Ragonot, 1887, cada una con su particularidad (ROESLER, 1973). Este género está actualizado en VIVES MORENO (2014), con subgéneros nuevos como Niethammeriodes Roesler, 1969 y Staudingeria Ragonot, 1887. Dada la complejidad de este género, sus estados inmaturos también tienen que diferenciarse, pero apenas sabemos cómo son, ya que no hay datos. En este trabajo aportaremos los que concierne a tres de ellos: Ancylosis .Ancylosis. cinnamomella(Duponchel, 1836), descrita de Montpellier (Francia), Ancylosis .Cabotia. oblitella (Zeller, 1848), descrita de Sarepta (Rusia europea) y Ancylosis .Syria. arenosella(Staudinger, 1859) descrita de Chiclana (Cádiz-España), con la particularidad de que pertenecen a tres subgéneros distintos. Los imagos de estas tres especies, así como sus genitalias lo podemos ver en ROESLER (1973).
Material y métodos
Las orugas de Ancylosis cinnamomella,fueron localizadas en Huelva, en la zona denominada “El Manto” en el Paraje Natural “Marismas del Odiel” el 17 y el 30-IV-2002, y el 18-IV-2003, en los que se descubrieron varios tubos de seda cubiertos de arena (la mayoría vacíos), sobre Sedum sediforme(Jacq.) Pau, destacándose los que subían por la planta, en ellos 6 orugas (Fig. 14 B), las más pequeñas se encontraban en las yemas terminales (Fig. 14 A) (HUERTAS-DIONISIO, 2007). Para poder seguir su ciclo biológico, estas orugas se separaron en botes de cristal con arena y una planta cada uno. En los días siguientes se observó que comen bien, por la cantidad de excrementos que hay. A final de abril una oruga pasa a crisálida en un capullo bajo la arena, emergiendo una hembra el 23-V-2002, las demás se secaron, parece difícil de criar.
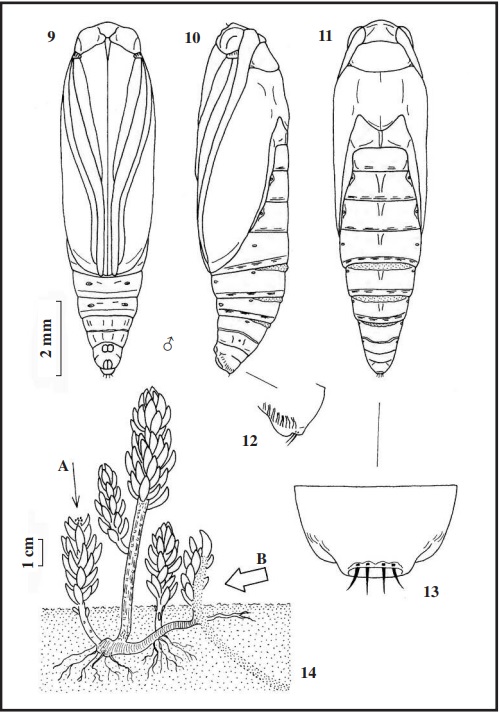
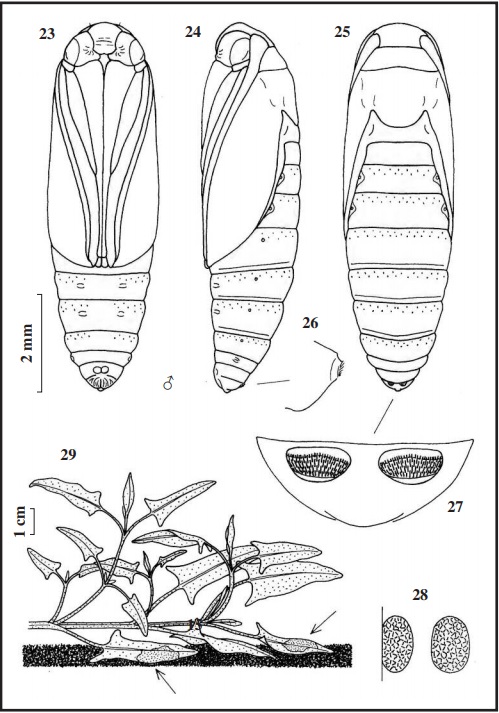
Las orugas de Ancylosis oblitella, fueron halladas por primera vez bajo las hojas rastreras de Atriplexprostrata Boucher (Fig. 29), el 15-VI-1988 en la Cascajera “Marismas del Odiel” (HUERTAS- DIONISIO, 2007), luego se separaron en botes individuales con su planta nutricia para seguir su ciclo biológico; desde junio hasta octubre se recogieron varias orugas sobre la misma planta, desarrollándose bien y saliendo los adultos en varias generaciones.
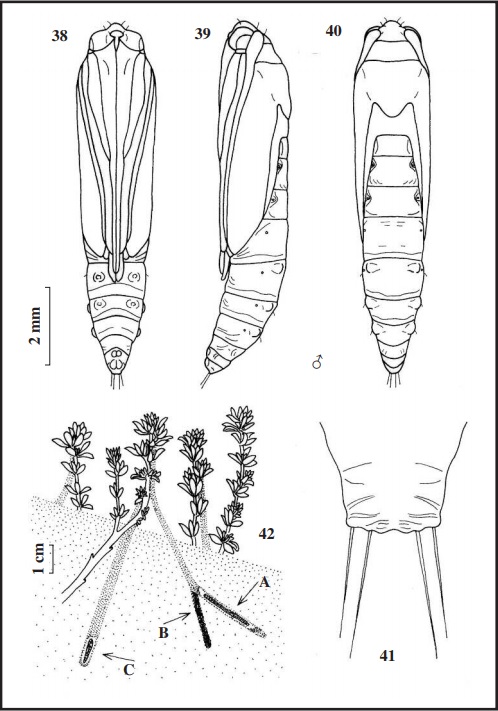
Las orugas de Ancylosis arenosella, fueron encontradas por primera vez en marzo de 1985, al observar tubos de seda que iban desde el suelo (arena) hasta la parte alta de Lotus creticusL. (Fig. 42), en las dunas de la Laguna de Las Madres. Para encontrar a la oruga, hay que cavar un poco hasta hallar el final del tubo oculto bajo la arena que puede llegar a medir hasta 15 cms de longitud (Fig. 42 A), que es donde se refugia la oruga. Una vez conseguidas las orugas en los meses de diciembre, enero, febrero y marzo, se distribuyeron en botes individuales con arena y su planta nutricia para observar su ciclo biológico. Para el acopio de las deyecciones, hacen una desviación del tubo principal donde la depositan (Fig. 42 B). Cuando van a pasar a crisálida, fabrican otro tubo más grueso, transformándose al final de éste (Fig. 42 C). Solo se ha observado a los adultos en marzo y abril. Junto con esta especie, podemos encontrar a Bryotropha figulella (Staudinger, 1859) (Gelechiidae) que vive en el mismo lugar y se alimenta de la misma planta y que pudiera dar lugar a confusión (HUERTAS-DIONISIO, 2010). Para el estudio de estas tres especies, las orugas se sacrificaron, primero anestesiándolas con agua y luego hervidas y conservadas en alcohol de 70º.
Morfología, biología y distribución
QUETOTAXIA
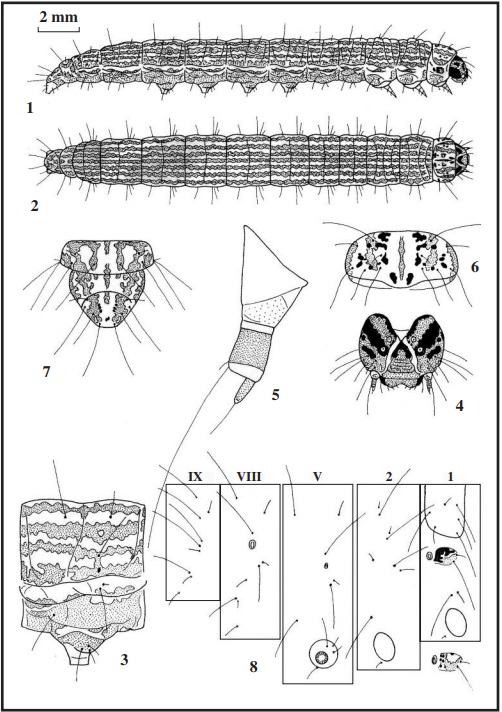
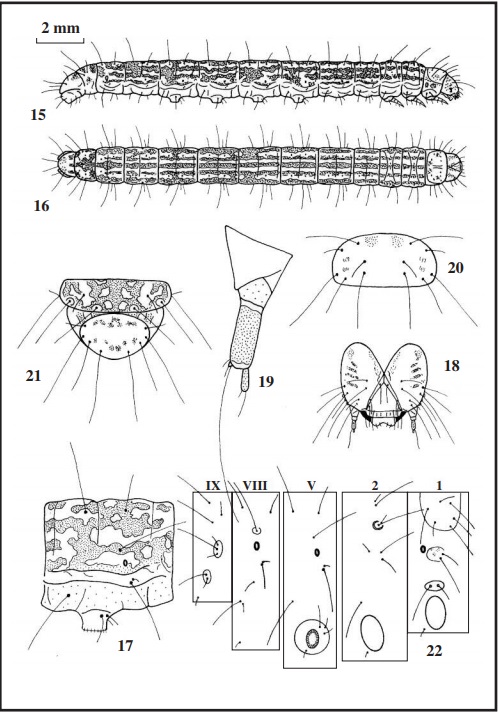
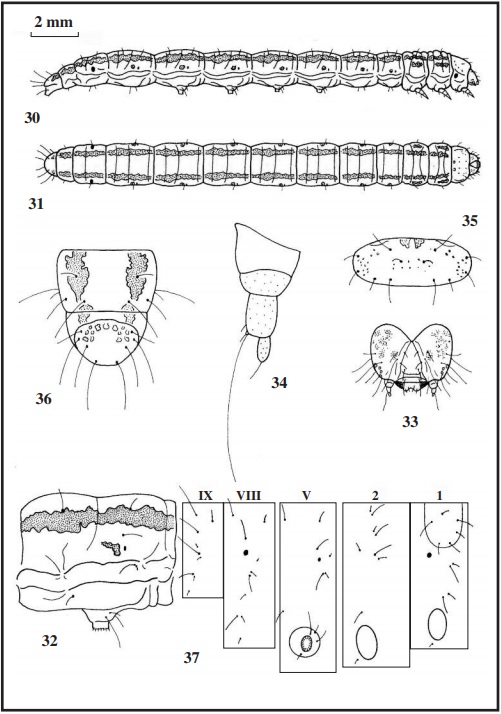
Al observar los mapas setales de las tres especies (Figs. 8, 22 y 37), vemos en primer lugar que las setas de arenosella son más cortas que las de las otras dos especies. En el escudo protorácico, la seta D1 de arenosella, está más centrada, y forma un triángulo con las setas D2 y XD1; sin embargo en las otras dos especies, estas tres setas están casi alineadas, estando la D1 más cerca de XD1. En el mesotórax y metatórax, la seta SD2 está por detrás de SD1 en arenosella, y por delante en las otras dos especies; en los mismos uritos, las setas L1 L2 y L3 están alineadas en cinnamomella y arenosella, y formando un triángulo en oblitella. En los uritos I a VII, las setas L1 y L2, están situadas aproximadamente de forma horizontal en arenosella, y de forma vertical en las otras dos especies. En los uritos VIII y IX, están presentes todas las setas, con ligera variación en su posición, solo la seta D1 está más retirada de D2 y SD1 en arenosella y más cercana a SD1 en las otras especies. En oblitella, las setas SD1 del mesotórax y octavo urito, están ligeramente pupiladas, lo que no ocurre con las otras especies. En el escudo anal (Figs. 7, 21 y 36 con el 9º urito), la seta D1 (corta) está encima de la seta SD2 (larga), disposición típica de los Phycitinae. Con lo expuesto aquí, se ha observado que arenosella difiere en ciertos aspectos de las otras dos especies.
Ancylosis (Ancylosis) cinnamomella (Duponchel, 1836)
Como nos parece interesante, reproducimos la experiencia y los datos de la cría de esta especie (determinada como Heterographis lafauryella Ragonot, 1879) hecha por LAFAURY (1885): “La oruga de longitud 10 mm, alargada,, con los segmentos 2º, 3º y 4º mucho más anchos que los siguientes, adelgazado gradualmente desde el 4º hasta el segmento anal, amarillo verdoso en su zona anterior y amarillo rojizo en los últimos segmentos, lo mismo por encima que por debajo. Cabeza muy pequeña casi oculta bajo el 2º segmento, aplanada, verde amarillento un poco brillante. Ocelos grandes, negros; las piezas de la boca rojo oscuro. Escudo protorácico grande, mucho más ancho que la cabeza, verde amarillento mate, poco relieve; cuando la oruga anda queda cubierta dos tercios de la cabeza. Cerca de cada extremidad y un poco por detrás, se distingue el primer par de espiráculos, grandes y amarillentos. Setas dorsales y subdorsales muy finas, rojizas. Las otras blanquecinas a veces invisibles. Escudo anal sin relieve, del color del escudo protorácico. Espiráculos amarillentos. Patas torácicas delgadas, verde amarillento, con uñas rojo oscuro. Las patas abdominales cortas, más verdosas que el vientre, con uñas rojizas, las anales más robustas y del mismo color.
Hemos encontrado esta oruga en Capbreton (Francia), sobre Astragalus bayonenses Loisel, que crece sobre nuestras dunas. Vive en un tubo de seda recubierto de granos de arena, mide 3 cm de largo, es rastrero sobre la superficie o enterrado a corta profundidad; uno de sus extremos está fijado a la cara inferior de las hojas del Astragalus, que come respetando la cara superior, en la que se aprecia una zona blancuzca que hace que se descubra de esta manera a la oruga. Se parece a lo que hace la oruga de I. dilucidella (Duponchel, 1836) con un tubo con numerosas bifurcaciones, sobre todo en las orugas jóvenes. Se cría difícilmente, y entre los cientos de orugas de todas las edades que se capturaron cada vez que se visitó el borde del mar, no he podido tener más que una eclosión en 1877. Las recogidas el 18-VII, dejaron de comer y de una de ellas salió el adulto el 10-VIII siguiente. Entre los restos de arena y plantas contenidas en la caja de cría, no se pudo encontrar el capullo, por lo que no he podido describir ni la crisálida. Esta especie, como otras que habitan nuestro litoral, debe volar de modo no interrumpido durante el verano. He capturado en 1883 un individuo de esta especie el 12-VII mientras que los Astragalus eran devorados por sus orugas. También el 26-VIII, otro individuo y el mismo día abundantes orugas de todos los tamaños, hasta de las más pequeñas de 2 a 3 mm de longitud”.
Según CHRETIEN (1930), la oruga sobre Sedum sexangulare L., en muros de piedras o bordes de caminos, en un tubo de seda al pie de la planta, a lo largo de los tallos y entre las hojas carnosas. El capullo lenticular. Tiene dos generaciones. No se ha podido consultar el trabajo de DISQUÉ (1906), pero HASENFUSS (1960), anota lo que dice este autor: “la oruga vive en junio y septiembre en las raíces de Sedum acre L. y Globularia sp.”. Según LHOMME (1935) la oruga también sobre Artemisia campestris L. Del huevo no se tienen datos.
Ampliaremos la descripción de la oruga en su último estadio (Figs. 1 y 2), esta mide 20 mm de longitud, verde claro con líneas longitudinales rosáceas de aspecto sinuoso que recorren todo el cuerpo que denominaremos de la siguiente forma: 1) línea dorsal fina; 2) línea supradorsal (entre la línea dorsal y las setas D1D2); 3) línea interdorsal (entre las setas dorsales y la subdorsal); 4) línea subdorsal (línea que toca a la seta SD1); 5) línea espiracular (línea entrecortada que toca al espiráculo); 6) línea pleural (solo apreciable con manchas rosas entrecortadas por debajo de las setas L1L2); 7) línea sublateral (forma una gran mancha rosa que toca a la seta L3) y 8) línea o mancha subventral (que toca a las setas SV1, SV2 y SV3); el vientre es rosáceo (Fig. 3 quinto urito abdominal). Setas amarillo claro a translúcidas. Tabula subcuadrangular (Figs. 1 y 8) variable, con manchas negras más o menos extendidas, y una mancha rosa pegada a las setas L1L2. Espiráculos elípticos, pardo claro con el peritrema castaño oscuro. Patas torácicas amarillentas, con una mancha castaño oscuro en la base del fémur. Patas abdominales coronadas, con uñas grandes y pequeñas alternadas, con un número variable de 52 a 64, las anales de 33 a 35 uñas. La ocrea (mancha en las patas anales) subtriangular, gris pálido con una pequeña mancha rosa, en ella están insertadas las setas L1 L2 y L3. La cápsula cefálica (Fig. 4) mide de 1,45 a 1,50 mm de ancha, pardo claro con manchas castaño oscuro. En las antenas (Fig. 5), la antacoria translúcida con una mancha amarillenta; el artejo basal translúcido; el artejo medio amarillo con la zona inferior translúcida y el artejo terminal amarillo. El escudo protorácico (Fig. 6) verde grisáceo, en el centro una línea rosa y entre las setas D2 SD2 XD1 y XD2 una banda rosácea junto a varias manchas castaño oscuro, y en el borde una línea rosa. El escudo anal (en la Fig. 7 con el 9º urito) verde amarillento con manchas rosáceas y otras más pequeñas castaño oscuro.
La crisálida (Figs. 9, 10 y 11) mide de 9 a 10 mm de longitud, verde amarillento muy claro; en el dorso del abdomen líneas rosa claro, entrecortadas y muy débiles, que recuerdan a las líneas de la oruga. En la zona anterior del dorso de los uritos 5, 6 y 7, tiene una rugosidad transversal que sobresale de la cutícula, de color pajizo con numerosos puntos parduscos. El último urito (Figs. 12 y 13) es corto, liso, chato, con cuatro puntas castañas inclinadas hacia el vientre, insertadas en una oquedad. El capullo lo hacen en el mismo tubo de la oruga.
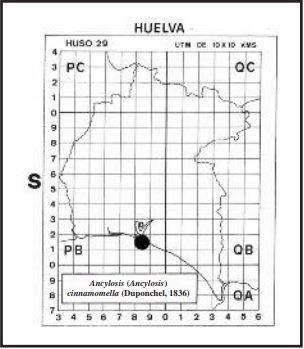
Según ROESLER (1973) y KARSHOLT & RAZOWSKI (1996), vuela en casi toda Europa y norte de África, llegando hasta Asia Central. En Huelva, se ha localizado a las orugas en El Manto (Paraje Natural: “Marismas del Odiel”) UTM 29SPB81 en abril de 2002 y 2003, sobre Sedum sediforme(Jacq.) Pau (Fig. 14) (HUERTAS DIONISIO, 2007) (ver mapa). En definitiva, la oruga es polífaga, habiéndosela encontrado sobre: Astragalus bayonenses Loisel, Sedum sexangulare L., Sedum acre L., Sedum sediforme (Jacq.) Pau (Fig.), Globularia sp. . Artemisia campestris L.
Ancylosis (Cabotia) oblitella (Zeller, 1848)
Según CHRETIEN (1917): “Los adultos eclosionaron en julio-agosto, de orugas que vivían en las flores de Acacia tortilis (Hayne),recolectadas en junio en Biskra (Argelia). La oruga no ha sido observada. Tiene varias generaciones: de marzo a junio y de julio a octubre”. Diversos autores citan también a Acacia farnesiana (L.) como mencionada por Chrétien en el trabajo de 1917, pero en realidad no hemos encontrado esta cita, parece ser una confusión con Acacia tortilis. El huevo y la larva fueron descritos someramente por FORD (1957): “La hembra se capturó el 11-V-1956, esa noche puso huevos, son casi esféricos, de 0,5 x 0,4 mm; corion liso. Color muy pálido que cambió a naranja claro el 15-V. La larva nació el 24-V. Estas larvas se alimentaron de Chenopodiumsp. El día 29-VII una larva madura, que mide 14 mm de longitud, cabeza negra, línea dorsal pardusca, dos líneas subdorsales y dos laterales más estrechas y pálidas, todas las líneas rotas en los segmentos, particularmente la línea primera subdorsal. Setas cortas, oscuras. La larva hizo un capullo y pasó a crisálida a los diez días, emergiendo el adulto macho el 30-VIII-1956”. Según GLASER (1960) la larva sobre Suaedamaritima (L.) Dum.
La descripción de los estados inmaturos de la población existente en Huelva es la siguiente: el huevo (Fig. 28) es elíptico, subcilíndrico, de 0,50 x 0,35-0,40 mm, amarillo pálido, corion con un reticulado muy débil, apenas destacable, dando un aspecto de superficie lisa. Al día siguiente se vuelve rosáceo. A los seis días nacen las orugas, que miden de 1 a 1,50 mm de longitud, cuerpo translúcido con líneas longitudinales muy finas pardo claro, del mismo color pero más claro, son la cápsula cefálica, el escudo protorácico y el escudo anal, en la cabeza se destaca el área ocelar redonda y negra. Hay orugas que no presentan este aspecto, sino que son más claras. La oruga de última edad (Figs. 15 y 16) mide 17 mm de longitud, verde claro con manchas muy quebradas pardo rosáceo en todo el cuerpo, que a veces forman líneas entrecortadas (Fig. 17 quinto urito abdominal). Setas rubias. Tabula redondeada con manchas rosas. Espiráculos elípticos, amarillentos con el peritrema castaño y muy grueso. Las patas torácicas translúcidas con tonalidad verdosa. Las patas abdominales cortas, verde claro, con 34 a 40 uñas grandes y pequeñas amarillentas que cierran el círculo (coronadas); las anales de 30 a 31 uñas. La cápsula cefálica (Fig. 18) mide 1,25 mm de ancho, verde claro con manchas parduscas, el área ocelar castaña (según FORD [1957] la cabeza es negra). En las antenas (Fig. 19), la antacoria translúcida con una mancha amarillo claro en la zona inferior; el artejo basal translúcido, y los artejos medio y terminal amarillo claro. El escudo protorácico (Fig. 20) verde claro con pequeñas manchas pardo claro. El escudo anal (en la Fig.21 con el 9º urito) verde claro con manchas pequeñas pardo claro. La crisálida (Figs. 23, 24 y 25) mide 7,50 mm de longitud, color pajizo; cabeza redondeada, el extremo de la espiritrompa no llega al final de las alas; en la zona ventral de los uritos V y VI se aprecian las cicatrices de las patas abdominales y en los uritos II a VII tienen cicatrices redondas (hoyuelos) apenas perceptibles. El último urito (Figs. 26 y 27) no tiene setas, es liso, solo presenta dos excrecencias rugosas en la zona anterior (ectipo) en cuya superficie hay numerosas espinas parduscas.
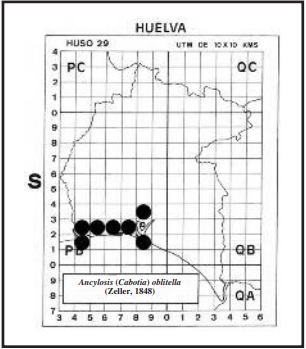
Según ROESLER (1973) y KARSHOLT & RAZOWSKI (1996), vuela en casi toda Europa y norte de África, extendiéndose hasta Asia central. En Huelva se la ha localizado en las marismas de Isla Cristina (zona de Ayamonte) UTM 29SPB41 y 29SPB42 (HUERTAS DIONISIO, 2002); La Redondela (Isla Cristina) UTM 29SPB52; Marismas del Rio Piedras (Cartaya) UTM29SPB62; Estero de Domingo Rubio (Palos de la Frontera) UTM29SPB81; Isla Saltes (Paraje Natural “Marismas del Odiel” (Huelva) UTM29SPB81 (HUERTAS DIONISIO, 2007), y en Los Puntales (Gibraleón) UTM29SPB72 y El Pintado (Gibraleón) UTM29SPB83, (ver mapa). Según los datos que tenemos, las orugas se alimentan de Atriplex prostrata, Chenopodium sp. . Suaeda maritima, y posiblemente de otras Amaranthaceae (Subfam. Chenopodioideae), y no de Acacia tortilis . Acacia farnesiana, árboles de la familia Fabaceae,que en principio descartamos.
Ancylosis (Syria) arenosella (Staudinger, 1859)
Los estados inmaturos nunca han sido descritos, por lo que se hace aquí por primera vez. Del huevo no se tienen datos. La oruga de última edad (Figs. 30 y 31), mide de 18 a 20 mm de longitud, blanco amarillento, con una línea irregular de color rosa a cada lado del cuerpo y por debajo de las setas dorsales, esta línea recorre todo el cuerpo, excepto el protórax. Por detrás de los espiráculos de los uritos I a VII tiene una pequeña mancha del mismo color (Fig. 32 quinto urito abdominal), esta mancha también está en los laterales del mesotórax y metatórax. Espiráculos color castaño. Patas torácicas translúcidas. Patas abdominales pequeñas, blanco amarillento, coronadas con 45 uñas. Setas rubias a translúcidas. La cápsula cefálica (Fig. 33) mide 1 mm de ancha, blanco amarillento con manchas doradas dispersas por los hemisferios, ocelos negros. En las antenas (Fig. 34), la antacoria translúcida con la zona inferior amarillenta; artejo basal translúcido y los otros artejos amarillo claro. El escudo protorácico (Fig. 35), blanco amarillento con pequeñas manchas rosas. El escudo anal (en la Fig. 36 con el 9º urito) también blanco amarillento con algunas manchas de aspecto translúcido. La crisálida (Figs. 38, 39 y 40) es muy estilizada, de 10 mm de longitud, color pajizo claro, algunos ejemplares tiene en el dorso manchas muy tenues rosas, que recuerdan a las de la oruga; el final de las antenas y de las patas metatorácicas sobresalen del final de las alas. En la zona dorsal de los uritos V a VII, tiene por encima de los espiráculos una excrecencia redondeada. En la zona ventral de los uritos V y VI, se le aprecian las huellas de las patas falsas. El final del abdomen (Fig. 41), es subcuadrangular a redondeado, ligeramente rugoso, con cuatro setas rectas y rígidas (sin curvar) de color rosáceo, las centrales (D2) mayores que las laterales (SD1).
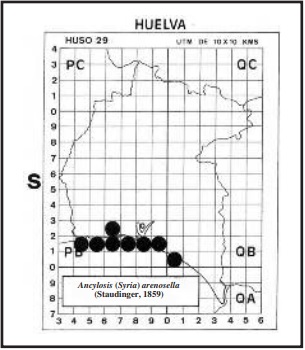
Según ROESLER (1973) vuela en España (Chiclana-Cádiz y Gran Canaria) y norte de África, llegando hasta Sudán y Palestina. También ha sido localizada en las dunas del Faro de Trafalgar (Barbate-Cádiz) (HUERTAS-DIONISIO et al., 2013). En Huelva se la ha localizado en las dunas costeras de: Ayamonte UTM 29SPB41 (HUERTAS-DIONISIO, 2002); La Antilla (Lepe) UTM 29SPB51;
Nueva Umbría (Lepe) UTM 29SPB61 y 29SPB62; Los Enebrales (Punta Umbría) UTM 29SPB71; Laguna de las Madres (Palos de la Frontera) UTM 29SPB81 y Marismas del Odiel (Huelva) UTM 29SPB81 (HUERTAS-DIONISIO, 2007); Mazagón (Palos de la Frontera) UTM 29SPB91 y El Asperillo (Almonte) UTM 29SQB00, (ver mapa). Por los datos obtenidos, la oruga se alimenta en España exclusivamente de Lotus creticus L. (Fabaceae).
Discusión
Observadas las láminas de las orugas y las crisálidas de estas tres especies pertenecientes al mismo género, pero en distintos subgéneros, se ve muy claro las diferencias entre ellas, aunque las orugas son estilizadas, la que más destaca es la de arenosella por las dos líneas rosáceas que recorre todo el cuerpo y por las setas más cortas. Con respecto a las otras dos especies, ambas tienen en todo el cuerpo líneas pardo rosáceas, alineadas en cinnamomella y entrecortadas en oblitella, aunque la verdadera diferencia está en la cápsula cefálica, verdosa en oblitella y pardo claro con manchas castaño oscuro en cinnamomella. Para más diferencias podemos ver el apartado QUETOTAXIA. Las crisálidas también tienen diferencias apreciables, destacando la esbeltez de la de arenosella, con las cuatro puntas del final del abdomen; las dos excrecencias rugosas (ectipo) del último urito de oblitella y de la oquedad del final del abdomen de la que salen cuatro puntas oscuras en cinnamomella.
BIBLIOGRAFÍA
CHRÉTIEN, P., 1917.– Contribution à la connaissance des lépidoptères du Nord de l´Afrique. Notes biologiques et critiques.– Annalesde la Société entomologique de France, 85: 369-502.
CHRÉTIEN, P., 1930.– Chenilles de Phycides de la faune Française.– Amateur de Papillons, .: 33-38.
DUPONCHEL, P. A. J., 1836.– Histoire naturelle des Lépidoptères ou papillons de France. Nocturnes, 7: 1-384. Paris.
FORD, L. T., 1957.– A note on the ova and larva of Heterographis oblitellaZ. (Lep.: Phycitidae).– Entomologist´s Gazette,.: 27.
GLASER, W., 1960.– Zur Frage der ersten Stände von Heterographisoblitella Z. (Lep.: Anerastiinae).– Zeitschriftder Wiener Entomologischen Gesellschaft,45: 157-158.
HASENFUSS, I., 1960.– Die Larvalsystematik der Zünsler (Pyralidae).– Abhandlungenzur Larvalsystematik der Inserten, .: 1-263.
HUERTAS-DIONISIO, M., 2002.– Lepidopteros de Huelva (I). Especies detectadas en las márgenes del río Guadiana.– Boletín de la Sociedad Andaluza de Entomología, .: 6-27.
HUERTAS-DIONISIO, M., 2007.– Lepidópteros de los Espacios Naturales Protegidos del Litoral de Huelva (Micro y Macrolepidoptera).– Boletín de la Sociedad Andaluza de Entomología, Monográfico, .: 1-248.
HUERTAS-DIONISIO, M., 2010.– Estados inmaturos de Lepidoptera (XXXVIII). Bryotropha figulella(Staudinger, 1859) en Huelva, España (Lepidoptera: Gelechiidae).– SHILAP Revista de lepidopterología, 38(150): 133- 137.
HUERTAS-DIONISIO, M., VÁZQUEZ GARCÍA, R. & SÁNCHEZ-GULLÓN, E., 2013.– Aportaciones para un Catálogo de Lepidoptera y flora del Parque Natural de la Breña y Marismas de Barbate (Cádiz, Andalucía, España).– Boletín de la Sociedad Andaluza de Entomología, 21: 12-21.
KARSHOLT, O. & RAZOWSKI, J., 1996.– The Lepidoptera of Europe. A distributional checklist: 380 pp. Apollo Books, Stenstrup.
LAFAURY, M. C., 1885.– Descriptions de chenilles de Microlépidoptères inédites ou peu connues.– Annales de la Société Entomologique de France, 1886: 397-422.
LHOMME, L., 1935.– Crambidae (Pyralidae), Galleriidae.– Catalogue des Lépidoptères de France et de Belgique, Microlépidoptères,.(1): 1-264.
ROESLER, R. U., 1973.– Phycitinae. 1. Teilband: Trifine Acrobasiina. In H. AMSEL, F. G. GREGOR & H. REISSER.– MicrolepidopteraPalaearctica, .: XVI + 752 + 137 pp., 170 pls. Verlag Georg Fromme & Co. Wien.
STAUDINGER, O., 1859.– Diagnosen nebst kurzen Beschreibungen neuer Andalusischer Lepidopteren.– Stettin Entomologische Zeitung , 20: 211-259.
VIVES MORENO, A., 2014.– Catálogo sistemático y sinonímico de los Lepidoptera de la Península Ibérica, de Ceuta, de Melilla y de las islas Azores, Baleares, Canarias, Madeira y Salvajes (Insecta: Lepidoptera): 1184 pp., Suplemento de SHILAP Revista de lepidopterología, Madrid.