

Estrutura da comunidade de borboletas frugívoras na Mata Atlântica do Litoral Sul da Bahia (Brasil) (Lepidoptera: Nymphalidae)
Structure of the community of frugivorous butterflies in the Atlantic Forest on the south coast of Bahia (Brazil) (Lepidoptera: Nymphalidae)
Estructura de la comunidad de mariposas frugívoras en el Bosque Atlántico del sur de Bahía (Brasil) (Lepidoptera: Nymphalidae)
Estrutura da comunidade de borboletas frugívoras na Mata Atlântica do Litoral Sul da Bahia (Brasil) (Lepidoptera: Nymphalidae)
SHILAP Revista de lepidopterología, vol. 44, núm. 176, 2016
Sociedad Hispano-Luso-Americana de Lepidopterología
Recepción: 06 Agosto 2015
Aprobación: 10 Octubre 2015
Publicación: 30 Diciembre 2016
Resumo: O estado da Bahia é considerado prioritário para a realização de trabalhos com borboletas, pois a sua riqueza, diversidade e sazonalidade é pouco conhecida nos seus vários biomas. A estrutura da comunidade de Nymphalidae frugívoros foi estudada na Mata Atlântica do Litoral Sul da Bahia. Coletas mensais durante seis meses foram realizadas em três áreas na Estação Ecológica Estadual de Wenceslau Guimarães (2.418 ha), utilizando armadilha tipo Van Someren-Rydon. Em 8.640 horas/armadilha foram coletados 523 indivíduos pertencentes a 59 espécies e 5 subfamílias de Nymphalidae. A floresta secundária apresentou maior riqueza e abundância e maior similaridade entre as unidades amostrais. A curva de acumulação de espécies não atingiu a assíntota.
Palavras-chave: Lepidoptera, Nymphalidae, diversidade, riqueza, Mata Atlântica, Brasil.
Abstract: Studies about the diversity and seasonality of Lepidoptera in Bahia State are considered priorities because of general poor knowledge of many of its biomes. The composition of the frugivorous Nymphalidae community was studied in the Estação Ecológica Estadual de Wenceslau Guimarães, a 2,418 ha area of Atlantic Forest, on the southern coast of Bahia State. The Lepidoptera were sampled in three different habitats, with Van Someren-Rydon trap. Over 8,640 trap/hours, 523 individuals belonging to 59 species and 5 subfamilies of Nymphalidae, were collected. The secondary forest registered the highest richness, abundance and similarity between the different sampling units. The species accumulation curve has not reached the asymptote.
Keywords: Lepidoptera, Nymphalidae, diversity, richness, Atlantic Forest, Brazil.
Resumen: El estado de Bahía es prioritario para realizar trabajos con Lepidoptera, por su riqueza, diversidad y estacionalidad y poco conocido en sus diversos biomas. La estructura de la comunidad frugívora de Nymphalidae, fue estudiada en la Mata Atlântica del litoral sur de Bahía. Se realizaron recogidas mensuales durante seis meses en tres áreas de la Estação Ecológica Estadual de Wenceslau Guimarães (2.418 ha), utilizando trampas tipo Van Someren-Rydon. En 8.640 horas / trampa, fueron recogidos 523 individuos pertenecientes a 59 especies y 5 subfamilias de Nymphalidae. Un bosque secundario presenta una mayor riqueza, abundancia y mayor similitud entre las unidades similares. Una curva de acumulación de especie no muestra una asintonía.
Palabras clave: Lepidoptera, Nymphalidae, diversidad, riqueza, Bosque Atlántico, Brasil.
Introdução
A Mata Atlântica é um dos biomas com a maior biodiversidade e um dos mais impactados pelas ações antrópicas, sendo considerado um dos “hotspots” da biodiversidade mundial (GALINDO-LEAL & CÂMARA, 2005). Em decorrência deste processo de antropização, a Mata Atlântica se encontra amplamente fragmentada e foi reduzida a pequenas áreas de floresta (MORELLATO & HADDAD, 2000). Nos últimos anos, alguns estudos têm analisado a estrutura de comunidade de borboletas e a dinâmica desses organismos em alguns biomas brasileiros, por exemplo, UEHARA-PRADO et al. (2007) que avaliaram a influência da fragmentação do ambiente na estrutura da comunidade de borboletas frugívoras no domínio da Mata Atlântica. BROWN & FREITAS (2000) analisaram a influência de fatores ambientais e climatológicos na estrutura da comunidade de borboletas, mencionando o uso de espécies raras e ameaçadas como indicadoras de ambientes mais preservados e que necessitam de atenção especial.
As borboletas frugívoras pertencem à família Nymphalidae e têm notável potencial como indicadores biológicos, em função da sensibilidade às mudanças ambientais, além de ciclo de vida curto e por serem especializadas e de fácil amostragem com armadilhas atrativas, podendo ser coletados de modo sistematizado sem interferência da habilidade do coletor (BROWN & FREITAS, 2000; UEHARA-PRADO et al., 2004).
A amostragem de borboletas frugívoras permite que sejam identificadas e soltas com o mínimo de manuseio, possibilitando a realização de estudos não destrutivos (UEHARA-PRADO et al., 2004). As borboletas são organismos carismáticos, com cores atrativas, a maior parte do grupo é conspícua, tendo grande potencial para serem utilizadas como “flagship species” em programas de conservação (BROWN, 1970; FREITAS & MARINI-FILHO, 2011). No entanto, ainda são pouco estudadas nas Unidades de Conservação do Brasil (FREITAS & MARINI-FILHO, 2011).
A família Nymphalidae é amplamente distribuída, sendo estimadas cerca de 2000 espécies para a região Neotropical, das quais 788 ocorrem no Brasil (BROWN & FREITAS, 1999). Na região Nordeste, KERPEL et al. (2014) registraram 139 espécies de Nymphalidae, sendo uma das famílias com maior riqueza para essa região.
Os Nymphalidae estão divididos em 11 subfamílias compondo duas guildas: nectarívoros e frugívoros de acordo com os hábitos dos adultos (LAMAS, 2004; DUARTE et al., 2012). Em florestas tropicais, as borboletas frugívoras compreendem entre 40% a 55% das espécies de Nymphalidae (DEVRIES & WALLA, 2001; SANTOS et al., 2011), representados principalmente por quatro subfamílias: Satyrinae, Morphinae, Charaxinae, Biblidinae, além da tribo Coeini (Nymphalinae) (FREITAS & BROWN, 2004; LAMAS, 2004).
Em algumas regiões do país, já foram elaboradas listas de espécies e guias de campo com borboletas frugívoras. Estes estudos se concentram em São Paulo, Rio Grande do Sul e Distrito Federal (BROWN, 1992; SILVA et al., 2003; UEHARA-PRADO et al., 2004, 2005, 2007; PETTIROSSI, 2009; TESTON & CORSEUIL, 2008; PEDROTTI et al., 2011; SANTOS et al., 2011; PAZ et al., 2013). A grande maioria dos estados brasileiros, principalmente a Bahia, necessita desses estudos para conhecimento da fauna em seus biomas (SANTOS et al., 2008; FREITAS & MARINI-FILHO, 2011).
Diante disso, este estudo, o primeiro realizado em uma área considerada Prioritária para Conservação (APC) da Mata Atlântica no estado da Bahia, teve como objetivo conhecer a estrutura da comunidade de borboletas frugívoras da Estação Ecológica Estadual de Wenceslau Guimarães, no litoral sul da Bahia, disponibilizando informações para futuros trabalhos de conservação e biomonitoramento.
Material e métodos
ÁREA DE ESTUDO
O estudo foi realizado na Estação Ecológica Estadual de Wenceslau Guimarães (EEEWG), considerada Área Prioritária para Conservação (APC) na categoria proteção integral. Está localizada no município de Wenceslau Guimarães, região Baixo Sul da Bahia, com área total de 2.418 ha (Figura 1). A sede da EEEWG está localizada nas coordenadas geográficas 13.35’43’’S e 39.43’10’’O (BAHIA, 2010).
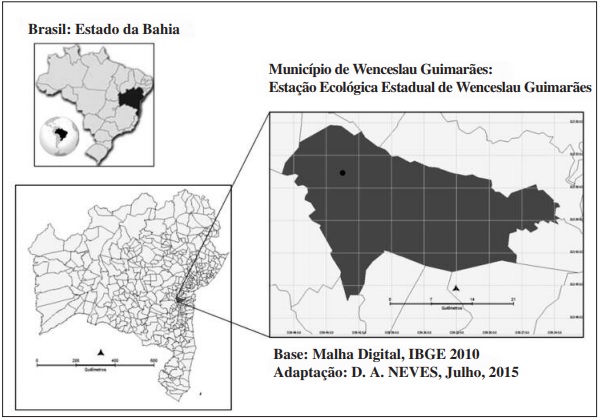
Esta APC localizada no bioma Mata Atlântica, é caracterizada como uma Floresta Ombrófila Densa de formação submontana. A altitude varia entre 200 m a 500 m, apresenta clima litorâneo úmido (Classificação de Köppen). A temperatura média anual varia entre 22 C a 25,5 C e os índices pluviométricos anuais encontram se na faixa entre 800 mm a 1.500 mm (BAHIA, 2010).
Com base na Resolução CONAMA nº 5, de 4 de maio de 1994, RIGUEIRA et al. (2012), mapas e informações históricas disponibilizados pelo guarda florestal da EEEWG foram definidas três áreas distintas: floresta primária, floresta secundária e borda.
A floresta primária apresenta máxima expressão local, a ação humana não provocou significativas alterações nas suas características originais e das estruturas de espécies e possui grande diversidade biológica. Floresta secundária ou em regeneração resulta dos processos naturais de sucessão, após supressão total ou parcial da vegetação primária em decorrência das ações humanas ou causas naturais, podendo ocorrer árvores remanescentes da vegetação primária. Borda consiste na margem da floresta com menor adensamento foliar e consequentemente, mais exposta à insolação e à modificação do regime de ventos.
DADOS ABIÓTICOS
Os dados das condições climatológicas do período de coleta foram obtidos do Instituto Nacional de Meteorologia (INMET) para a estação mais próxima da EEEWG, Itiruçu – Jaguaquara (BA) (OMM: 83295) (INMET, 2014). As médias mensais de temperatura e precipitação foram obtidas da base de dados do Climatempo, onde as médias climatológicas são valores calculados a partir de uma série de dados de 30 anos de observação (CLIMATEMPO, 2015).
AMOSTRAGEM
Foram realizadas coletas mensais com duração de quatro dias durante seis meses (outubro de 2013 a março de 2014), compreendendo a estação de menor pluviosidade. Foi realizada uma amostragem padronizada para borboletas frugívoras seguindo o método proposto por UEHARA- PRADO et al. (2005). De acordo com esse método foram utilizadas armadilhas portáteis do tipo Van Someren-Rydon (VSR), com isca atrativa constituída de uma mistura de banana amassada com caldo de cana, respectivamente na proporção 3:1, fermentada por 48 horas, sendo utilizados 250 ml por armadilha.
Em cada um dos habitats (Floresta primaria, Floresta secundária e Borda) foram estabelecidas 03 unidades amostrais (UAs) com distância de 200 m entre as UAs. Cada UA foi constituída por quatro armadilhas VSR dispostas linearmente, com aproximadamente 1,8 m de altura e 25 m de distância uma das outras. A utilização de quatro subamostras por UA visou diminuir o efeito da posição da armadilha e da atratividade das iscas sobre a probabilidade de captura das borboletas (DEVRIES & WALLA, 2001). Todas as armadilhas foram revisadas quatro vezes a cada coleta, com revisão a cada 24 h. O esforço de coleta resultou em 8640 horas\armadilha de amostragem, considerando um período de 10 h de coleta efetiva diária (UEHARA-PRADO et al., 2007).
CLASSIFICAÇÃO TAXONÔMICA
A nomenclatura das espécies e posicionamento taxonômico da família, subfamílias e tribos estão de acordo com LAMAS (2004).
O material biológico foi depositado no acervo do Laboratório de Sistemática e Conservação de Insetos (LASCI), Setor de Ciências Biológicas, Universidade Federal do Recôncavo da Bahia (UFRB), Cruz das Almas, BA.
ANÁLISES DOS DADOS
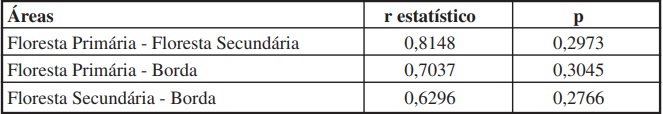
As espécies representadas por um único indivíduo foram denominadas “singletons” (NOVOTNY & BASSET, 2000). Seguindo a metodologia de NOBRE et al. (2008) foram consideradas raras as que tiveram no máximo 3 indivíduos capturados, N= 4-10 frequentes e N>10 comuns. Para as análises de diversidade foram empregados os índices de diversidade beta (Whittaker), Equabilidade Shannon-Wiener (J) e Dominância de Berger-Parker (Dbp) e para estimativa da riqueza de espécies foi utilizado o estimador Chao-1. As médias foram comparadas através do Teste .. Foi realizada a análise de similaridade (ANOSIM) unifatorial, com base no índice de similaridade de Morisita. O valor de “p” foi corrigido pela técnica de Bonferroni. E a análise de agrupamento (cluster) foi realizada utilizando o coeficiente de Morisita. Todas as análises foram realizadas usando software Past 2.07 (HAMMER et al., 2001).
Resultados
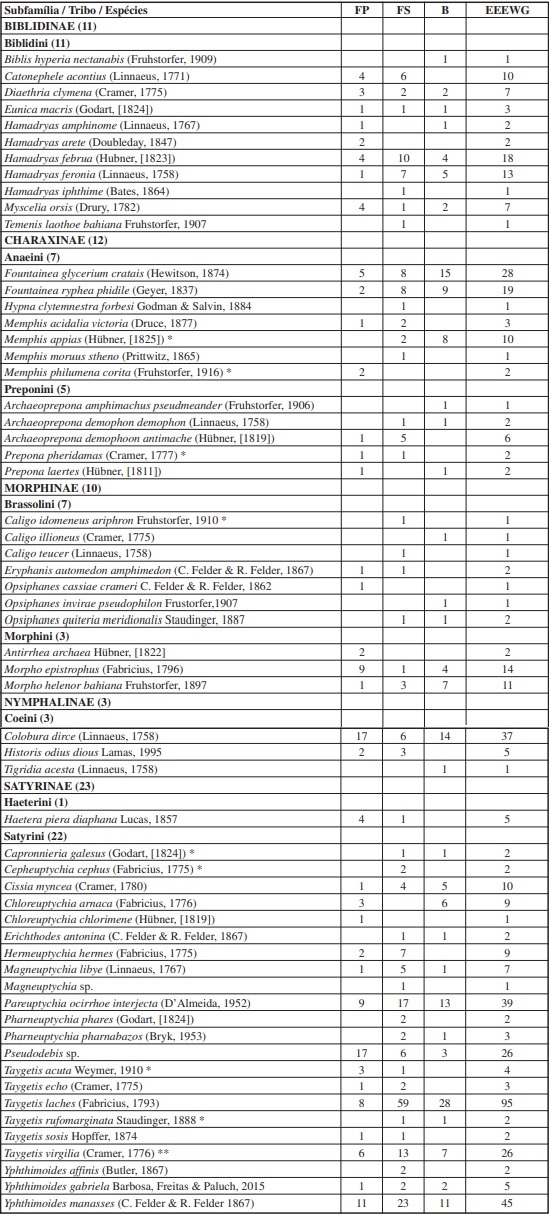
Foram coletados 523 indivíduos distribuídos em 59 espécies, pertencentes a 5 subfamílias de Nymphalidae (Tabela I). Trinta e sete espécies foram coletadas na floresta primária (das quais 5 foram exclusivas dessa área), na floresta secundária foram obtidas 46 espécies (10 exclusivas) e na borda 33 espécies (sendo 5 exclusivas) (Tabela II). Dezoito espécies (30,5%) foram comuns às três áreas.
Médias seguidas pela mesma letra nas linhas não diferem estatisticamente entre si pelo Teste t, a 5% de probabilidade.
Médias seguidas pela mesma letra nas linhas não diferem estatisticamente entre si pelo Teste ., a 5% de probabilidade.
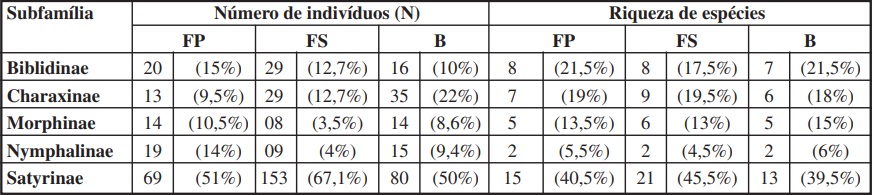
Satyrinae foi a subfamília mais representativa quanto a riqueza e abundância, com 302 indivíduos e 23 espécies coletadas, seguida de Charaxinae (77 indivíduos, 12 espécies), Biblidinae (65 indivíduos, 11espécies), Morphinae (36 indivíduos, 10 espécies) e Nymphalinae (43 indivíduos, 3 espécies) (Tabela III).
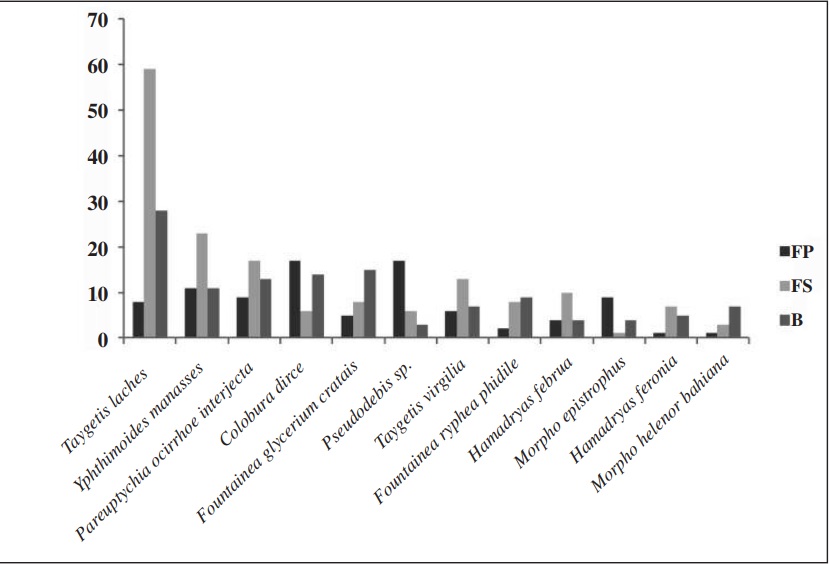
As três espécies mais comuns na EEEWG foram coletadas em maior abundância na floresta secundária e pertencem a subfamília Satyrinae, sendo elas Taygetis laches(Fabricius, 1793), Yphthimoides manasses(C. Felder & R. Felder, 1867) e Pareuptychia ocirrhoe interjecta (D’Almeida, 1952), que juntas corresponderam a 34% de todos os indivíduos coletados (Figura 2). Dentre as espécies classificadas como frequentes, Catonephele acontius (Linnaeus, 1771), Memphis appias (Hübner, [1825]) e Cissia myncea (Cramer, 1780) foram as mais abundantes, com 10 indivíduos cada uma (Figura 3).
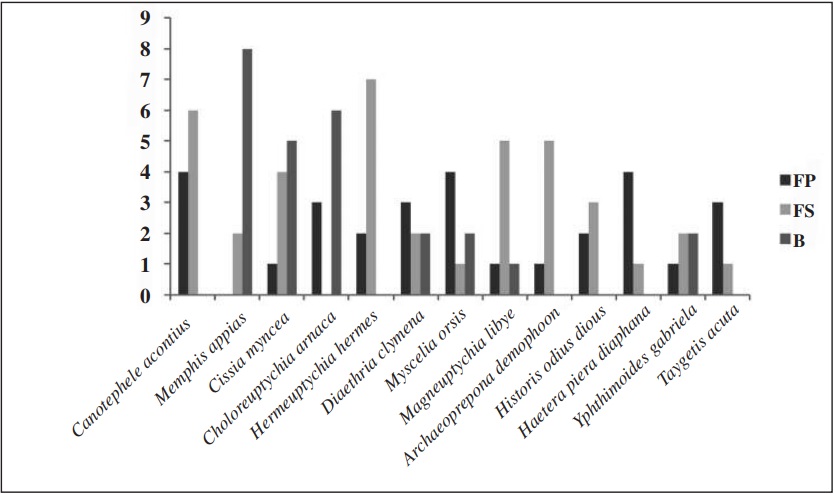
A comunidade de borboletas foi representada por poucas espécies abundantes e muitas espécies raras. Do total de espécies amostradas nas áreas estudadas, 23% (S= 14) foi representada por apenas um indivíduo (singletons), sendo 2 na floresta primária, 7 na secundária e 5 na borda (Tabela II).
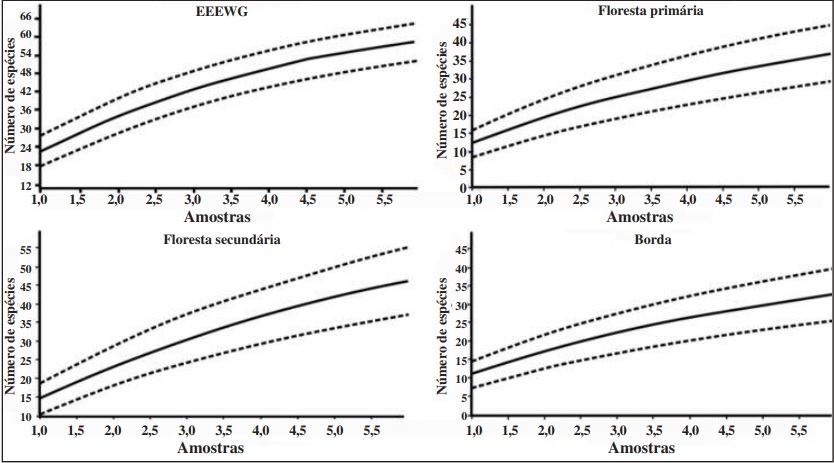
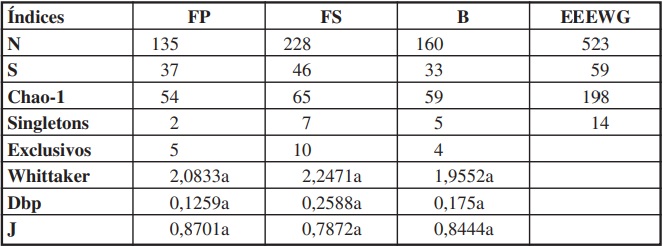
A curva de acumulação de espécies não atingiu a assíntota (Figura 4). O número total de espécies estimadas para a EEEWG, segundo o estimador de riqueza Chao-1 foi 198. Quando analisadas separadamente, a riqueza estimada para floresta primária foi de 54 espécies, secundária 65 e para borda 59 (Tabela II).
Quanto ao índice de diversidade de Whittaker, dominância de Berger Parker e equitabilidade J, não foi observada diferença significativa entre as áreas estudadas (P> 0,05), como pode ser observado na Tabela II. A floresta secundária apresentou maior riqueza (S= 46) e maior abundância (N= 228).
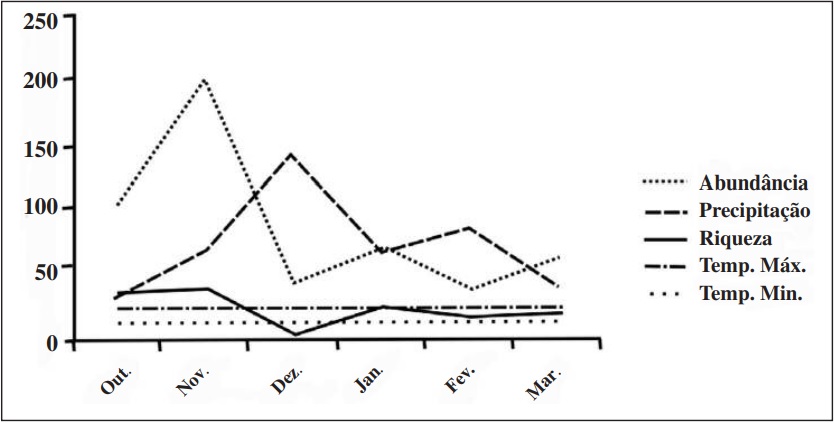
Os meses de dezembro e fevereiro tiveram maior precipitação, 144.7 mm e 89.5 mm respectiva- mente e foram os meses que apresentaram menor riqueza (S= 5; S= 19) e menor abundância (N= 43; N= 39) respectivamente. Durante todo o período de coleta não houve variação significativa da tempera- tura, a máxima ficou em torno de 28 C e a mínima 18 C (Figura 5).
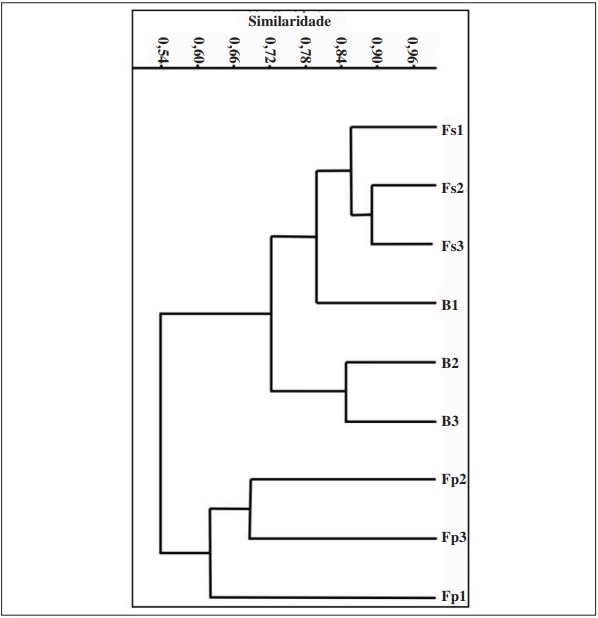
A análise de similaridade (ANOSIM) apontou diferença significativa entre as três áreas, com maior valor de “R” para a floresta primária e floresta secundária (Tabela IV). E a análise de agrupamento (cluster) identificou a formação de dois grupos, um compreendendo as unidades amostrais da floresta primária e outro constituído pela floresta secundária e borda (Figura 6). Neste segundo, as unidades amostrais não formaram dois grupos bem definidos, com segregação de uma das unidades amostrais da borda, que apresentou maior similaridade com a floresta secundária.
Discussão
Apesar do período de amostragem ter sido relativamente curto, a riqueza de espécie de borboletas frugívoras encontrada na EEEWG pode ser considerada alta para a região Nordeste, uma vez que o número de espécies apresentadas neste trabalho foi maior que o encontrado em outros estudos realizados em área de Mata Atlântica e em outros biomas dessa região, mesmo quando estes apresentam resultados permutados de coleta com armadilha e rede entomológica e alguns com maior esforço amostral (NOBRE et al., 2008; VASCONCELOS et al., 2009; PALUCH et al., 2011; ZACCA & BRAVO, 2012; LIMA & ZACCA, 2014).
Dos ambientes estudados na região Nordeste, somente o Parque Estadual João Vasconcelos Sobrinho, Brejo de Altitude, que corresponde a um encrave de Mata Atlântica na região do semiárido, apresentou a riqueza de borboletas frugívoras semelhante a EEEWG, com maior riqueza para Satyrinae, seguido de Biblidinae e Charaxinae. Em outros biomas como Mangue (GARCIA et al., 1990) e Caatinga (D’ALMEIDA, 1935; NOBRE et al., 2008; ZACCA & BRAVO, 2012; LIMA & ZACCA, 2014) a maior riqueza de espécie foi encontrada na subfamília Biblidinae.
Essa diferença pode ser atribuída às características desses ambientes, que a depender do local pode favorecer um grupo de borboletas em detrimento de outro, uma vez que, borboletas apresentam alta especificidade e são diretamente influenciadas pelo padrão de distribuição dos recursos alimentares e microclimas (SINGER, 1984; DEVRIES, 1987; BROWN & FREITAS, 2000).
De acordo com RAMOS (2000), a alta dominância de Satyrinae pode implicar na maior riqueza e abundância de indivíduos de uma determinada área. Esse padrão também foi observado no presente trabalho, entretanto, mais de 50% dos indivíduos de Satyrinae, foram representados por T. laches, Y. manasses . P. ocirrhoe interjecta, com maior abundância na floresta secundária, área que apresentou maior riqueza e maior número de indivíduos. Espécies da subfamília Satyrinae são comumente encontradas em ambientes mais abertos, como a floresta secundária, devido a disponibilidade de recursos alimentares e plantas hospedeiras (BROWN & FREITAS, 2000; CORSO & HERNÁNDEZ, 2012).
Este estudo acrescentou nove registros novos de espécies de borboletas frugívoras, sendo um para o estado da Bahia e oito que eram desconhecidos para toda a região Nordeste. Também apresentou maior riqueza de Taygetis (S= 6) para essa região (D’ALMEIDA, 1935; CARDOSO, 1949; SILVA, 1967; KESSELRING & EBERT, 1982; GARCÍA et al.,1990; NOBRE et al., 2008; VASCONCELOS et al., 2009; PALUCH et al., 2011; ZACCA et al., 2011; NOBRE et al., 2012; ZACCA & BRAVO, 2012; LIMA & ZACCA, 2014). O grande número de registros novos de espécies de borboletas frugívoras para a Bahia e o Nordeste pode ser atribuído aos poucos estudos realizados na Mata Atlântica nordestina (SANTOS et al., 2008).
Embora o número de espécies amostradas seja relativamente alto, a curva de acúmulo de espécies, obtidas a partir dos dados mensais da amostra total, indica que estudos futuros podem acrescentar novos registros de espécies de borboletas frugívoras a EEEWG.
Do total de 59 espécies coletadas foi observada uma ocorrência em comum de 18 espécies nas três áreas. Muitas espécies apresentam preferência por determinadas famílias, gênero ou espécie de planta-hospedeira, portanto tem uma estreita relação com a vegetação de determinada área, com o padrão de distribuição de recursos e microclimas (SINGER, 1984; DEVRIES, 1987; BROWN & FREITAS, 2000). A ocorrência de algumas espécies restritas a um dos ambientes corrobora com o fato de que, embora apresentem uma similaridade faunística considerável (52%), as áreas mantêm suas peculiaridades como demonstrado na análise de similaridade ANOSIM.
A análise de agrupamento mostrou que algumas das unidades amostrais pré-definidas foram consistentes, a exemplo da floresta primária e secundária que mantiveram suas unidades amostrais agrupadas com similaridade relativamente alta. No entanto, a área de borda não formou um agrupamento conciso, uma de suas unidades formou um grupo independente, apresentando maior similaridade com as unidades amostrais da floresta secundária (78%) (Figura 6). Isso pode indicar que a borda, definida inicialmente com base na fitofisionomia não constitui um ambiente totalmente diferente da floresta secundária.
Embora o CONAMA indique que a floresta secundária esteja em estágio inicial de regeneração (BRASIL, 1994), os resultados obtidos no presente trabalho demonstraram que ela apresenta uma similaridade relativamente alta com a floresta primária (52%). Isso é notado ao observar na floresta secundária a presença de algumas espécies indicadoras de áreas preservadas, com abundância semelhante à floresta primária, como Taygetis echo (Cramer, 1775) e Taygetis virgilia (Cramer, 1776) (RAMOS, 2000), assim como Morpho epistrophus (Fabricius, 1796), espécie indicadora de ambientes bem preservados (BROWN & FREITAS, 2000), que também foi coletado na floresta secundária, mas em número reduzido.
Estudos em ambientes fragmentados tem mostrado uma forte correlação entre a elevada abundância de alguns Satyrinae e Biblidinae e áreas perturbadas, por exemplo, Hamadryas februa (Hübner, [1823]) e T. laches que em ambientes perturbados são bem comuns, podendo ser amostrado centenas de indivíduos em uma única coleta (RIBEIROS, 2006; UEHARA-PRADO et al., 2007). Entretanto, isso não ocorreu na EEEWG, provavelmente pelo avançado estágio de regeneração da floresta secundária, que não favoreceu a abundância desses organismos. Em todo período de coleta T. laches, a mais comum, foi representada por 96 indivíduos e H. februa por 10 espécimes.
Quando se observa as médias mensais de precipitação calculadas a partir de dados obtidos em 30 anos de observações (CLIMATEMPO, 2015) nota-se que o período escolhido para as coletas (outubro a março), compreende os meses com menor precipitação, entretanto, 2013 foi um ano atípico, pois diferente do esperado, o mês de dezembro apresentou uma precipitação acima da média (Figura 5).
Os resultados obtidos com borboletas frugívoras neste trabalho evidencia a importância de preservar a EEEWG, pois constitui um dos redutos da biodiversidade tanto para Bahia, como para o Brasil. Sendo necessário mantê-la como área prioritária para conservação, pois mesmo tendo uma parte considerada floresta secundária, esta se mostrou semelhantes à floresta primária, indicando o estágio avançado de recuperação e a importância para a manutenção de muitas espécies. O excelente resultado obtido com as borboletas frugívoras, um grupo bioindicador, pode ser projetado para outros grupos de animais e plantas.
BIBLIOGRAFIA
BAHIA, 2010.– Relatório técnico: caracterização da Estação Ecológica Estadual de Wenceslau Guimarães. Salvador, Governo do Estado da Bahia. Secretaria do Meio Ambiente, Bahia.
BRASIL, 1994.– Resolução do CONAMA nº 5, de 4 de maio de 1994. Define vegetação primária e secundária nos estágios inicial, médio e avançado de regeneração da Mata Atlântica da Bahia.– Diário Oficial da União, 101(1): 7912-7913.
BROWN JR, K. S., 1970.– Rediscovery of Heliconius nattereri in eastern Brazil.– Entomological News, 81:129- 140.
BROWN JR, K. S., 1992.– Borboletas da Serra do Japi: diversidade, hábitats, recursos alimentares e variação temporal.– In L. P. C. MORELLATO. História Natural da Serra do Japi: Ecologia e preservação de uma área florestal no sudeste do Brasil: 321 pp. Unicamp, São Paulo.
BROWN JR., K. S. & FREITAS, A. V. L., 1999.– Lepidoptera.– In C. R. F. BRANDÃO & E. M. CANCELLO. Biodiversidade do Estado de São Paulo, Brasil. Invertebrados terrestres: XVI+279 pp. FAPESP, São Paulo.
BROWN JR, K. S. & FREITAS, A. V. L., 2000.– Diversidade de Lepidoptera em Santa Teresa, Espírito Santo.– Boletim do Museu de Biologia Mello Leitão, 11(12): 71-118.
CARDOSO, A., 1949.– Lepidópteros de Alagoas.– Revista Brasileira de Entomologia, 20(1/ 3): 427- 436.
CLIMATEMPO, 2015.– Climatologia de Wenceslau Guimarães Ba. Disponível em http://www.climatempo.com.br/climatologia/5354/wenceslauguimaraes-ba. (acesso em 19 de Janeiro de 2015).
CORSO, G. & HERNÁNDEZ, M. I. M., 2012.– Borboletas frugívoras da Mata Atlântica no Parque Estadual da Serra do tabuleiro, Santa Catarina, Brasil.– Biotemas, 25(4): 139-148.
D’ALMEIDA, R. F., 1935.– Lista dos lepidópteros capturados pelo Dr. R. V. Ihering no nordeste do Brasil.– Revista de Entomologia, .(3): 326-328.
DEVRIES, P. J., 1987.– The butterflies of Costa Rica and their natural history: 327pp. Princeton University Press, Princeton.
DEVRIES, P. J. & WALLA, T. R., 2001.– Species diversity and community structure in Neotropical fruit-feeding butterflies.– Biological Journal of the Linnean Society, 74: 1-15.
DUARTE, M., MARCONATO, G., SPECHT, A. & CASAGRANDE, M. M., 2012.– Lepidoptera.– In J. A. RAFAEL, G. A. R. MELO, C. J. B. CARVALHO, S. A. CASARI & R. CONSTANTINO (Ed.). Insetos do Brasil: diversidade e taxonomia: 810 pp. Holos, Ribeirão Preto.
FREITAS, A. V. L. & BROWN JR., K. S., 2004.– Phylogeny of the Nymphalidae (Lepidoptera).– Systematic Biology, 53(3): 363-383.
FREITAS, A. V. L. & MARINI-FILHO, O. J., 2011.– Plano de Ação Nacional para Conservação dos Lepidópteros Ameaçados de Extinção: 124 pp. ICMBio, Brasília.
GALINDO-LEAL, C. & CÂMARA, I. G., 2005.– Status do hotspot Mata Atlântica: uma síntese.– In C. GALINDO-LEAL & I. G. CÂMARA eds. Mata Atlântica: Biodiversidade, ameaças e perspectivas: 156 pp. Fundação SOS Mata Atlântica, Belo Horizonte.
GARCIA, I. P., BERGMANN, E. C. & RODRIGUES, S. M., 1990.– Diversidade mensal de borboletas na ilha de São Luís (MA).– Arquivo do Instituto de Biologia, 57(1): 39-44.
HAMMER, Ø., HARPER, D. A. T., & RYAN, P. D., 2001.– PAST: Paleontological Statistics Software Package for Education and Data Analysis.– Palaeontologia Electronica, 4(1): 1-9.
INMET (INSTITUTO NACIONAL DE METEREOLÓGIA), 2014.– Estação Meteorológica de Observação de Superfície Convencional. Disponível em http://www.inmet.gov.br/portal/. (acessado em 02 de Novembro de 2014).
KERPEL, S. M., ZACCA, T., NOBRE, C. E. B., FERREIRA JÚNIOR, A., ARAÚJO, M. X. & FONSECA, A., 2014.– Borboletas do Semiárido: conhecimento atual e contribuições do PPBio.– In F. BRAVO & A. CALOR (Org.). Artrópodes do Semiárido: biodiversidade e conservação: 298 pp. Printmídia, Feira de Santana.
KESSELRING, J. & EBERT, H., [1982].– Relação das borboletas encontradas na “Mata do Buraquinho”, João Pessoa, estado da Paraíba, Brasil.– Revista Nordestina de Biologia, .(1/ 2): 105-118.
LAMAS, G., 2004.– Atlas of Neotropical Lepidoptera, Checklist: Part 4A, Hesperioidea-Papilionoidea: 439 pp. Association for Tropical Lepidoptera, Gainesville.
LIMA, J. N. R. & ZACCA, T., 2014.– Lista de espécies de borboletas (Lepidoptera: Hesperioidea e Papilionoidea) de uma área de Semiárido da Região Nordeste do Brasil.– EntomoBrasilis, .(1): 33-40.
NOBRE, C. E. B., SCHLINDWEIN, C. & MIELKE, O. H. H., 2008.– The butterflies (Lepidoptera: Papilionoidea and Hesperioidea) of the Catimbau National Park, Pernambuco, Brazil.– Zootaxa, 1751: 35-45.
NOBRE, C. E. B., IANNUZZI, L. & SCHLINDWEIN, C., 2012.– Seasonality of fruit-feeding butterflies (Lepidoptera, Nymphalidae) in a Brazilian Semiarid Area.– International Scholarly Research Network Zoology, 2012: 1-8.
NOVOTNY, V. & BASSET, Y., 2000.– Rare species in communities of tropical insect herbivores: pondering the mystery of singletons.– Oikos, 89(3): 564-572.
PALUCH, M., MIELKE, O. H. H., NOBRE, C. E. B., CASAGRANDE, M. M., MELO, D. H. A. & FREITAS, A. V. L., 2011.– Butterflies (Lepidoptera: Papilionoidea and Hesperioidea) of the Parque Ecológico João Vasconcelos Sobrinho, Caruaru, Pernambuco, Brazil.– Biota Neotropica, 11(4): 229-238.
PAZ, A. L. G., ROMANOWSKI, H. P. & MORAIS, A. B. B., 2013.– Borboletas frugívoras do centro oeste do Rio Grande do Sul, Brasil (Lepidoptera: Nymphalidae).– SHILAP Revista de lepidopterología, 41(164): 1-14.
PEDROTTI, V. S., BARROS, M. P., ROMANOWSKI, H. P. & ISERHARD, C. A., 2011.– Borboletas frugívoras (Lepidoptera: Nymphalidae) ocorrentes em um fragmento de Floresta Ombrófila Mista no Rio Grande do Sul, Brasil.– Biota Neotropica, 11(1): 385-390.
PETTIROSSI, N., 2009.– Riqueza, abundância e composição de espécies de borboletas frugívoras (Lepidoptera, Nymphalidae) da Reserva Florestal Mata de Santa Genebra, Campinas, Brasil.– Boletim do Museu de Biologia Mello Leitão, 25: 13-29.
RAMOS, F. A., 2000.– Nymphalid butterfly communities in an amazonian forest fragment.– Journal of Research on the Lepidoptera, 35: 29-41.
RIBEIROS, D. B., 2006.– A guilda de borboletas frugívoras em uma paisagem fragmentada no Alto Parnaíba-SP: 78pp. Dissertação (Mestrado em Ecologia) Universidade Estadual de Campinas, Campinas.
RIGUEIRA, D. M. G., MOLINARI, A. L. M., MARIANO, D. L. S., REIS, R. M., PORTUGAL, A. B., SANTANA, N. S. & SANTOS, R. A., 2012.– Influência da distância da borda e do adensamento foliar sobre a abundancia de plantas pioneiras em um fragmento de floresta tropical submontana na Estação Ecológica de Wenceslau Guimarães (Bahia, Brasil).– Acta Botanica Brasilica, 26(1): 197-202.
SANTOS, E. C., MIELKE, O. H. H. & CASAGRANDE, M. M., 2008.– Inventários de borboletas no Brasil: Estado da arte e modelo de áreas prioritárias para pesquisa com vista à conservação.– Revista Natureza & Conservação, .(2): 68-90.
SANTOS, J. P., ISERHARD, C. A., TEXEIRA, M. O. & ROMANOWSKI, H. P., 2011.– Fruit-feeding butterflies guide of subtropical Atlantic Forest and Araucaria Moist Forest in State of Rio Grande do Sul, Brazil.– Biota Neotropica, 11(3): 253-274.
SILVA, A. G., 1967.– Catálogo dos Lepidoptera Cearenses.– Revista do Instituto do Ceará, 91-112.
SILVA, J. M., CUNHA, S. K., SILVA, E. J. E. & GARCIA, F. R. M., 2003.– Borboletas Frugívoras (Lepidoptera: Nymphalidae) no Horto Botânico Irmão Teodoro Luis, Capão do Leão, Rio Grande do Sul, Brasil.– Biotemas, 26(1): 87-95.
SINGER, M. C., 1984.– Butterfly-hostplant relationships: host quality, adult choice and larval success.– In R. I. VANE-WRIGHT & P. E. ACKERY eds. The biology of butterflies: 464 pp. Academic Press Inc, Florida.
TESTON, J. A. & CORSEUIL, E., 2008.– Ninfalídeos (Lepidoptera, Nymphalidae) ocorrentes no Rio Grande do Sul, Brasil. Parte IV. Apaturinae e Charaxinae.– Biociências, 16(1): 28-32.
UEHARA-PRADO, M., FREITAS, A. V. L., FRANCINI, R. B. & BROWN JR, K. S., 2004.– Guia das borboletas frugívoras da Reserva Estadual do Morro Grande e Região de Caucaia do Alto, Cotia (SP).– Revista Biota Neotropical, .(1): 1-25.
UEHARA-PRADO, M., BROWN JR, K. S. & FREITAS, A. V. L., 2005.– Biological traits of frugivorous butterflies in a fragmented and a continuous landscape in the South Brazilian Atlantic Forest.– Journal of the Lepidopterists’ Society, 59(2): 96-106.
UEHARA-PRADO, M., BROWN JR, K. S. & FREITAS, A. V. L., 2007.– Species richness, composition and abundance of fruit-feeding butterflies in the Brazilian Atlantic Forest: comparison between a fragmented and a continuous landscape.– Global Ecology and Biogeography, 16: 43-54.
VASCONCELOS, R. N., BARBOSA, E. C. C. & PERES, M. C. L., 2009.– Borboletas do Parque Metropolitano de Pituaçu, Salvador, Bahia, Brasil.– Sitientibus Série Ciências Biológicas, .(9):158-164.
ZACCA, T., BRAVO, F. & XAVIER, M. X., 2011.– Butterflies (Lepidoptera: Papilionoidea and Hesperioidea) from Serra da Jibóia, Bahia State, Brazil.-Entomobrasilis, .(3): 139-143.
ZACCA, T. & BRAVO, F., 2012.– Borboletas (Lepidoptera: Papilionoidea e Hesperioidea) da porção norte da Chapada Diamantina, Bahia, Brasil.– Biota Neotropica, 12(2): 01-10.