

Novas espécies de Iliana Bell, 1937, incluindo novos sinônimos e notas taxonômicas, com a descrição de dois novos gêneros de Pyrgini (Lepidoptera: Hesperiidae)
New species of Iliana Bell, 1937, including new synonyms and taxonomic notes, with the description of two new genera of Pyrgini (Lepidoptera: Hesperiidae)
Nuevas especies de Iliana Bell, 1937, incluyendo nuevas sinonímias y notas taxonómicas, con la descripción de dos nuevos géneros de Pyrgini (Lepidoptera: Hesperiidae)
Novas espécies de Iliana Bell, 1937, incluindo novos sinônimos e notas taxonômicas, com a descrição de dois novos gêneros de Pyrgini (Lepidoptera: Hesperiidae)
SHILAP Revista de lepidopterología, vol. 44, núm. 176, 2016
Sociedad Hispano-Luso-Americana de Lepidopterología
Recepción: 16 Septiembre 2015
Aprobación: 12 Noviembre 2015
Publicación: 30 Diciembre 2016
Resumo: São descritas as seguintes novas espécies: Iliana bolivianus Mielke & Casagrande, sp. n., da Bolívia (La Paz); Iliana miersi Mielke & Casagrande, sp. n., do Brasil (Estados do Rio de Janeiro, Paraná, Santa Catarina) e Iliana nirtoni Mielke & Casagrande, sp. n., do Brasil (Estado do Rio de Janeiro). Tosta capra Austin, 1999, syn. n., e Tosta saltarana Steinhauser, 2007, syn. n., são sinônimos novos de Iliana romulus Bell, 1937. Dois novos gêneros são descritos: Austinus Mielke & Casagrande, gen. n., espécie tipo: Echelatus heros Mabille & Boullet, 1917 e Emmelus Mielke & Casagrande, gen. n., espécie tipo: Telemiades purpurascens Mabille & Boullet, 1912. Lectótipo de Echelatus heros Mabille & Boullet, 1917 e neótipo de Telemiades purpurascens Mabille & Boullet, 1912 são designados. Todas as espécies são figuradas, assim como suas genitálias; das fêmeas quando disponíveis. Novos registros de distribuição geográfica são mencionados.
Palavras-chave: Lepidoptera, Hesperiidae, novos gêneros, novas espécies, Neotropical.
Resumen: Se describen las siguientes nuevas especies: Iliana bolivianus Mielke & Casagrande, sp. n., de Bolivia (La Paz); Iliana miersi Mielke & Casagrande, sp. n., de Brasil (Estados de Rio de Janeiro, Paraná, Santa Catarina) e Iliana nirtoni Mielke & Casagrande, sp. n., de Brasil (Estado de Rio de Janeiro). Tosta capra Austin, 1999, syn. n., y Tosta saltarana Steinhauser, 2007, syn. n., son nuevas sinonimias de Iliana romulus Bell 1937. Se describen dos nuevos géneros: Austinus Mielke & Casagrande, gen. n., especie tipo: Echelatus heros Mabille & Boullet, 1917 y Emmelus Mielke & Casagrande, gen. n., especie tipo: Telemiades purpurascens Mabille & Boullet, 1912. Se designa el lectotipo de Echelatus heros Mabille & Boullet, 1917 y un neotipo para Telemiades purpurascens Mabille & Boullet, 1912. Se ilustran todas las especies, incluyendo sus genitalias masculinas, de la hembra sólo cuando están disponibles. Se dan nuevos datos de distribución.
Palabras clave: Lepidoptera, Hesperiidae, nuevos géneros, nuevas especies, Neotropical.
Keywords: Lepidoptera, Hesperiidae, new genera, new species, Neotropical
Introdução
Iliana Bell, 1937 foi estabelecido para incluir duas espécies peruanas bem caracterizadas pelos aspectos alares semelhantes, porém de morfologias diferentes nas genitálias masculinas. Iliana romulus Bell 1937 e Iliana remus Bell, 1937, são descritas no mesmo trabalho e baseadas somente no holótipo macho de cada uma, a primeira sendo a espécie tipo do gênero. EVANS (1953) foi o único autor a revisar o gênero, passando o número de espécies para quatro, pois incluiu Telemiades purpurascens Mabille & Boullet, 1912 e Echelatus heros Mabille & Boullet, 1917, e mencionando mais um exemplar de Iliana remus proveniente do Perú (Río Putumayo). Até então não houveram mais mudanças sistemáticas (MIELKE, 2004, 2005).
Recentemente ao estudar as espécies deste gênero, verificou-se na coleção do Departamento de Zoologia, Universidade Federal do Paraná, a existência de exemplares identificados como Tosta capra Austin, 1999, Tosta saltarana Steinhauser, 2007 e Anastrus peruvianus (Mabille, 1883), que pelo aspecto externo pareciam, e aqui são confirmados, como pertencentes a este gênero, além de exemplares das duas espécies de Iliana .I. romulus e .. remus) provenientes de localidades outras que as dos tipos. Ainda três espécies novas, uma da Bolívia (La Paz), uma do litoral sudeste do Brasil (Rio de Janeiro), e outra do sudeste e sul do Brasil (Rio de Janeiro, Paraná e Santa Catarina) são descritas.
Desta forma, um gênero que somente era conhecido como tendo espécies peruanas, agora possui espécies que ocorrem no Perú, Bolívia, Guiana Francesa e Brasil (Acre, Amazonas, Rondônia, Maranhão, Distrito Federal, Minas Gerais, Rio de Janeiro, Paraná e Santa Catarina). Verificou-se que duas espécies incluídas no gênero por EVANS (1953), Echelatus heros Mabille & Boullet, 1917 e Telemiades purpurascens Mabille & Boullet, 1912, em muito divergem da morfologia das espécies aqui incluídas em Iliana, razão de serem removidas para outros dois gêneros novos, descritos no final.
Material e métodos
Todos os exemplares estudados estão depositados nos seguintes museus e coleções (entre parênteses, os curadores quando por ocasião da coleta de dados):
AMNH - American Museum of Natural History, New York, USA (Dr. Frederick Rindge)
CZMA - Coleção Zoológica do Maranhão, Centro de Estudos Superiores de Caxias, Universidade Estadual do Maranhão, Caxias, Maranhão, Brasil (Dr. Francisco Limeira-de-Oliveira)
DZUP - Coleção Pe. Jesus Santiago Moure, Departamento de Zoologia, Universidade Federal do Paraná, Curitiba, Paraná, Brasil (Drs. Olaf Hermann Hendrik Mielke & Mirna Martins Casagrande)
LCRO - Coleção Jean François LeCrom, Bogotá, Cundinamarca, Colombia (Jean François LeCrom)
McG - McGuire Center for Lepidoptera and Biodiversity, Florida Museum of Natural History, Florida University, Gainesville, Florida, USA (Dr. Thomas C. Emmel)
MUSM - Museo de Historia Natural, Universidad Nacional Mayor de San Marcos, Lima, Perú (Dr. Gerardo Lamas)
MNHN - Muséum National d’Histoire Naturelle, Paris, França (Dr. Rodolphe Rougerie)
NHMUK - The Natural History Museum, London, U. K. (Drs. Richard I. Vane-Wright e Phillip R. Ackery)
OM - Coleção Olaf H. H. Mielke, Curitiba, Paraná, Brasil (Olaf H. H. Mielke); no Departamento de Zoologia, UFPR
ZMHU - Museum für Naturkunde, Leibnitz-Institut für Evolutions- und Biodiversitätsforschung an der Humboldt Universität, Berlin, Alemanha (Dr. Wolfram Mey)
ZUEC - Museu de Zologia da Universidade Estadual de Campinas, Unicamp, Campinas, São Paulo, Brasil (Dr. André Victor Lucci Freitas)
Os preparados das genitálias estão preservados em tubos de vidro com glicerina e alfinetados separadamente dos exemplares, mas com etiquetas identificadoras correspondentes, assim como com o mesmo número de depósito do exemplar.
No item “Distribuição geográfica” são mencionadas as procedências de exemplares encontradas em bibliografias, assim como em algumas coleções, com as referidas abreviaturas entre parênteses; os números arábicos se referem ao mês de coleta do(s) exemplar(es).
Os DNA barcodes foram obtidos junto ao Canadian Centre for DNA Barcoding através do gentil apoio do Dr. Rodolphe Rougerie e do Dr. Paul Hebert.
Iliana Bell, 1937
Iliana Bell, 1937. Amer. Mus. Novit., 914: 8; espécie tipo: Iliana romulusBell, 1937.– Shepard, 1944. Ann. Amer. Ent. Soc., 36: 757.– Evans, 1953. Cat. Amer. Hesp., 3: p. 9, 40.– Hemming, 1967. Bull. Brit. Mus. (Nat. Hist.), Ent., Suppl., .: 231.– Beattie, 1976. Rhop. Direct.: 31.– Bridges, 1983. Lep. Hesp., 2: 17.– Bridges, 1988a. Cat. Hesp., .: 28; App., .: 6.– Bridges, 1988b. Cat. Fam.-Group & Gen.-Group Nam., .: 63; 5, 7.– Bridges, 1994. Cat. Fam.-Group, Gen.-Group, Sp.-Group Nam., Hesp. (Lep.) World, .: 15; .: 7; 6, p. 1; .: 32.– O. Mielke, 2004. Hesperioidea: 6, 49.– In G. Lamas (ed.). Checklist: Part 4A, Hesperioidea-Papilionoidea. InJ. B. Heppner (ed.). Atlas Neotrop. Lep. 5A.– Mielke, 2005.Cat. Amer. Hesperioidea, .: 594.– DeVries, Austin & Martin, 2008. Biol. Jour. Linn. Soc., 94: 729.– Warren, Ogawa & Brower, 2008. Cladistics, 24: 25.– Warren, Ogawa & Brower, 2009.
Syst. Ent., 34: 487, 514.
Iliana sp. Janzen; Hallwachs & Burns, 2010. Proc. Nat. Acad. Sc., 107(26): Tab. S1, fig. S1a (larva), fig. S6a (larva), fig. S12c (pupa).
A referência original descreve o gênero com duas espécies novas (I. romulus . I. remus). EVANS (1953) redefine o gênero dentro de uma chave. DEVRIES et al. (2008) mencionam a hora de atividade dos adultos (provavelmente se referindo a Emmelus purpurascens (Mabille & Boullet, 1912), comb. n., à época como Iliana, e também a única espécie com registro para a área de estudo (Cacaulândia, Rondônia, Brasil). WARREN et al. (2008, 2009), sem examinar exemplares das espécies, o menciona em estudos filogenéticos como pertencente à Carcharodini. JANZEN et al. (2010) registram uma espécie nova. Os demais autores o mencionam em catálogos.
As espécies se inserem bem no subgrupo de Pyrgini, Pyrginae, denominado por EVANS (1953) de “Nisoniadessub-group”. Os 17 gêneros deste subgrupo possuem de acordo com EVANS (1953: 6) as seguintes características: “forewing no trace of the lower median veinlet; antennal apiculus shorter than the unbent portion of the club; antennae at least half as long as costa; antenal shaft plain; antennal apiculus slender, hooked; hindwing dorsum produced and generally larger than costa”. Também caracteriza as espécies destes gêneros por possuirem um unco simples, ou seja, não dividido, fato que não coincide com as suas ilustrações, uma vez que Iliana remus Bell, 1937, Morvina morvus (Plötz, 1884), Morvina fissimacula (Mabille, 1878) e Xispia quadrata(Mabille, 1889), do mesmo subgrupo, o apresentam bífido. Nas espécies de Iliana, o unco é largamente bífido, característico como em nenhum outro gênero deste subgrupo - os braços do unco estão afastados entre si pelo menos pelo comprimento dos mesmos e o gnato é único, com exceção do de I. romulus . I. nirtoni Mielke & Casagrande, sp. n., em que é dividido, porém com as partes próximas. Na valva, todas as espécies possuem uma área esclerotinizada na parte proximal da válvula e provida de uma série de longas cerdas. Na genitália feminina (I. remus . I. miersi - as únicas conhecidas) as lamelas antevaginal e pósvaginal são largas, separadas, imbricadas, de formato semi-retangular e irregulares.
WARREN et al. (2009), baseados em caracteres morfológicos e moleculares e sem ver exemplares, mencionam Iliana em Carcharodini, Pyrginae.
Sendo a diferença entre as duas classificações muito evidentes, prefere-se mantê-lo em Pyrgini, Pyrginae, até uma futura classificação com mais caracteres e possivelmente mais estável. Em se optando pelo gênero permanecer em Pyrginae, sensu WARREN et al. (2008, 2009), que também aceita Eudaminae Mabille, 1877, como outra subfamília, o nome correto da subfamília deveria ser Pyrrhopyginae Mabille, 1877, e não Pyrginae Burmeister, 1878, pois o primeiro nome tem prioridade sobre o segundo. Esta decisão pode acarretar uma grande confusão e a CIZN poderia ser consultada para utilizar os seus plenos poderes para decidir, no entanto, opta-se aqui pelo princípio da prioridade nos nomes dos táxons (ICZN, Art. 23) para evitar as numerosas exceções já estabelecidas por esta comissão.
As espécies de Ilianapossuem palpo curto para o subgrupo, diferente das espécies de Pellicia Herrich-Schäffer, 1870 e Austinus Mielke & Casagrande, gen. n., descrito mais adiante; nudo antenal varia de 25 a 30 artículos, sendo impossível diagnosticar quantos na massa terminal e no apículo; tíbia mediana sem espinhos e com um par de esporões; tíbia posterior com dois pares de esporões; asa anterior não truncada no ápice, célula discal menor que a margem posterior, prega costal alcançando o término da Sc ou R2 e contendo escamas marrons muito claras, quase brancas, sem manchas transparentes; face dorsal das asas de um marrom muito escuro a quase preto, com as margens externas levemente mais claras e com faixas escuras muito rudimentares; face ventral inteiramente de um marrom acinzentado, bem mais claro que na face dorsal, e no ângulo anal da asa posterior normalmente mais claro ainda ou ocre escuro, amarelo escuro ou azul claro.
Somente as fêmeas de duas espécies (.. remus e .. miersi) são conhecidas; semelhantes aos machos.
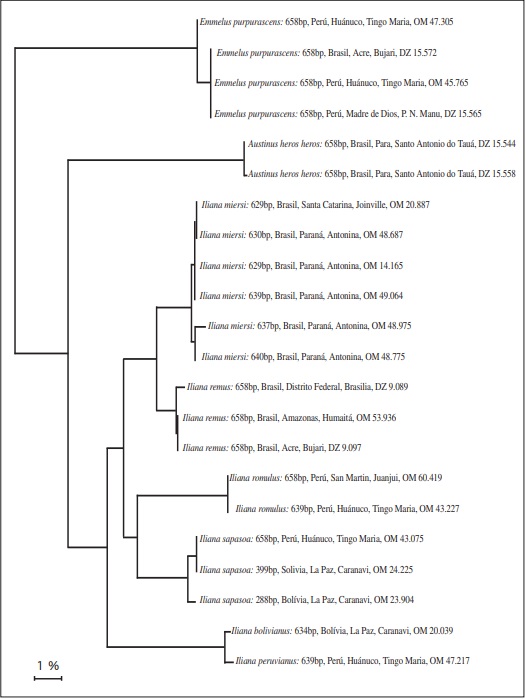
A análise de DNA barcodes distinguiu muito bem as espécies, como pode ser visto na Fig. 1.
Considerando que a maioria das espécies nunca foi figurada, apresenta-se fotografias e desenhos das genitálias de todas as espécies.
Lista das espécies de Iliana Bell, 1937
Tosta capra Austin, 1999, syn. n.
Tosta saltarana Steinhauser, 2007, syn. n.
Chave para as espécies, baseada em machos
Fêmeas não disponíveis.
Face ventral da asa posterior com margem externa azul ou de tons marrons 3
Face ventral da asa posterior com a margem externa, entre o ápice e o ângulo anal, amarela e franjas nas asas anterior e posterior amarelas. Bolívia (La Paz) I. bolivianus
Face ventral da asa posterior de tons marrons 4
Valva com a harpe curvada dorsalmente 5
Harpe com o processo dorso-terminal não sobrepondo a ampola, delgado com espinho terminal, sem espinho distal dobrado para o interior da genitália 6
Apófises do tegume curtas, não alcançando a divisão do unco, edeago reto. Brasil (Rio de Janeiro)...........................................................................................I. nirtoni
Iliana peruvianus(Mabille, 1883), comb. n. (Figs. 1, 2-3, 28, 40)
Eurypterus peruvianusMabille, 1883. Ann. Soc. ent. Belg., 27: LIII; no data; collection Mabille.–
Mabille & Vuillot, 1893. Novit. Lep., 10: 107, 111, pl. 15, fig. 4 (d, v). Aethilla peruviana [sic]; Mabille, 1903. In Wytsman. Gen. Ins., 17: 33.– Mabille & Boullet, 1919.
Ann. Sc. nat., Zool., Paris, (10).: 200, 202.– Draudt, 1922, In A. Seitz. Gross-Schmett. Erde, .: 876.–
Lamas, 1969. Biota, .: 329.
Aethilla peruvianus; Shepard, 1931. Lep. Cat., 47: 99; syn.: peruviana.
Anastrus peruvianus; Evans, 1953. Cat. Amer. Hesp., .: 186, pl. 47 (male gen.).– Bridges, 1983.
Lep. Hesp., 1: 92; 2, p. 2.– Bridges, 1988a. Cat. Hesp., .: 146; .: 3.– Bridges, 1994. Cat. Fam.-Group,
Gen.-Group, Sp. Group Nam. Hesp. (Lep.) World, .: 175; .: 3.– O. Mielke, 2004. Hesperioidea: 42. In
G. Lamas (ed.). Checklist: Part 4A, Hesperioidea-Papilionoidea. In J. B. Heppner (ed.). Atlas Neotrop.
Lep. 5A.– Mielke, 2005. Cat. Amer. Hesperioidea, .: 6; .: 431; syn.: peruviana.
(No genus) peruvianus; Beattie, 1976.Rhop. Direct.: 230.
Com exceção da citação de MABILLE (1883) que descreve a espécie, MABILLE & VUILLOT (1893), que figuram o macho (dorsal e ventral) e EVANS (1953) que figura a genitália masculina, as demais referências somente redescrevem ou mencionam a espécie em catálogos. A figura de MABILLE & VUILLOT (1893) é de um exemplar, sem procedência, com a área marginal externa da face ventral da asa posterior amarela, mais claro que no lectótipo, designado a seguir e que possui esta área ocre escura.
Esta espécie foi descrita sem indicar número de exemplares e sem qualquer dado. No NHMUK há um síntipo macho, examinado e aqui designado lectótipo para estabelecer a correta identificação da espécie (ICZN, 1999: Art. 74.7.); o exemplar possui as seguintes etiquetas: / Type / Type / Pérou / E. peruvianus Mab. type/ R. Oberthür Coll. Brit. Mus. 1931-136/ cartão com a genitália dissecada por Evans/; mais as seguintes duas serão afixadas: / Lectotypus/ Lectotype Eurypterus peruvianus Mabille, 1883, Mielke e Casagrande det. 2015/; estas serão enviadas ao curador da referida coleção.
O lectótipo não possui cabeça e parte da asa posterior esquerda está danificada.
Baseado em aspectos morfológicos, principalmente das asas e da genitália masculina, Eurypterus peruvianus Mabille, 1883 é incluída neste gênero: Iliana peruvianus(Mabille, 1883).
Diagnose: Espécie se caracteriza pela área marginal da face ventral da asa posterior ocre escuro, mais escuro que em I. bolivianus, contrastado com o restante da asa, e franjas em ambas as asas e faces negras.
Discussão: Pelos formatos do gnato e da valva, esta espécie sugere ser próxima de Iliana bolivianus Mielke & Casagrande, sp. n., descrita a seguir. Todo o conjunto muito semelhante à I. bolivianus, diferindo na face ventral da asa posterior pela tonalidade do ocre escuro, quase marrom, pela coloração das franjas e por sutis diferenças na genitália masculina.
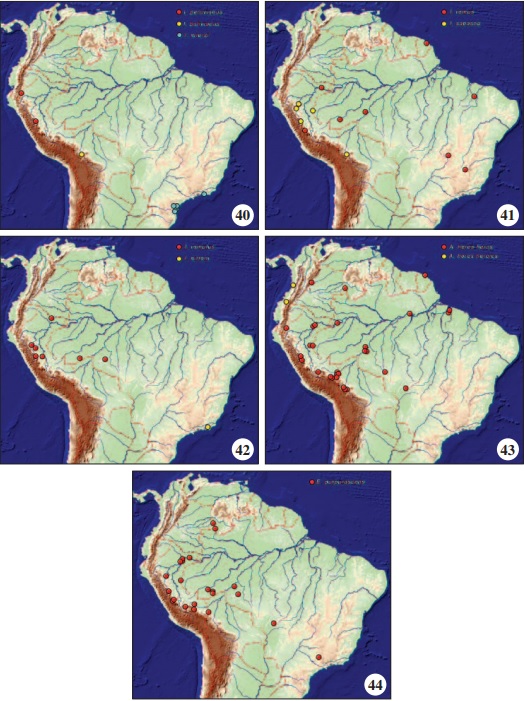
Distribuição geográfica (Fig. 40): Perú: Amazonas (Cordillera del Cóndor - VII) (MNHL); Huánuco (Tingo María - X) (OM).
MABILLE & BOULLET (1919) e SHEPARD (1931) a mencionam para a Bolívia, porém estas citações podem ser um engano, pois lá ocorre outra espécie, Iliana bolivianus, sp. nov. descrita a seguir. MABILLE & VUILLOT (1893) ilustram um exemplar, sem procedência, mas talvez da Bolívia, com a área marginal da face ventral da asa posterior amarela, como em I. bolivianus Mielke & Casagrande, sp. n., mas as franjas são como em I. peruvianus, ou seja, não destacadas e sim da mesma coloração das asas.
Iliana bolivianus Mielke & Casagrande, sp. n. (Figs. 1, 4-5, 29, 40)
Material tipo: Holótipo 1 com as seguintes etiquetas: / Holotypus / XI-XII-1990, Caranavi, N. Yungas, [La Paz,] Bolívia, 600-1000 m, C. Tello leg. / Holotypus Iliana bolivianus Mielke & Casagrande. Mielke & Casagrande det. 2015 / OM 25.596 / BC-DZ [barcoded] /; OM. Parátipos: 1 1, IX-X-1988, Caranavi, La Paz, Bolívia, 600-1000 m, C. Tello leg., OM 20.039 /; OM. 1 1, XII-2004, Caranavi, La Paz, Bolívia, 1000 m, C. Tello leg., OM 67.077 /; OM.
Diagnose: Espécie se caracteriza pela área marginal da face ventral da asa posterior e pelas franjas em ambas as asas e faces, assim como uma pequena área adjacente na face dorsal da asa posterior amarelo escuro, mais claro que I. peruvianus.
Descrição: Macho (Figs. 4, 5). Comprimento da asa anterior - 21-24 mm. Vértice, antenas, olhos, genas, palpos, tórax, pernas e abdome, inclusive ventralmente, marrons, quase negros.
Face dorsal das asas uniformemente marrom, quase negra, com as franjas amarelo escuras, assim como fina área adjacente na asa posterior. Prega costal até Sc, contendo escamas ocre claras. Área anal da asa posterior com escamas negras, finas, longas e eriçadas entre 2A e 3A.
Face ventral das asas marrom, quase negra, sendo a linha marginal amarelo clara, na asa anterior entre R4 e 2A e na posterior entre Rs e 3A, área marginal externa da asa anterior finamente amarelo escuro entre CuA1 e o ângulo anal, e franjas igualmente amarelo escuras em ambas as asas. Na asa anterior, área basal abaixo da célula discal, espaço CuA2-2A até quase as margens externa e interna acinzentados. Asa posterior com a área marginal externa, de 2,8 mm de largura máxima, com o mesmo formato que em I. peruvianus, amarelo escura, entre M1 e o ângulo anal.
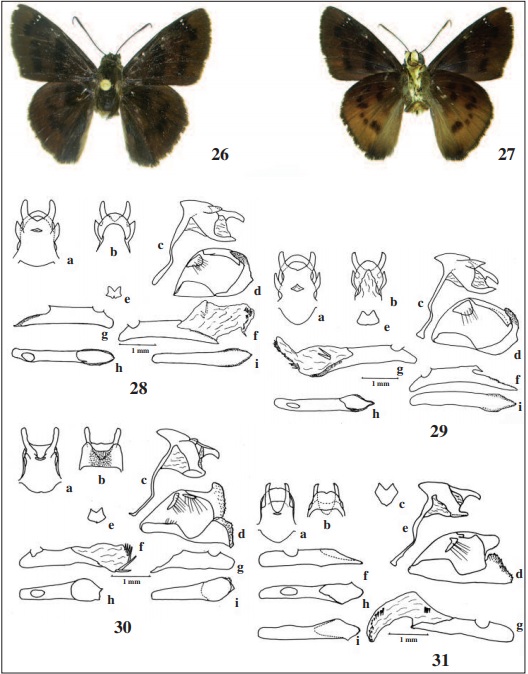
Genitália (Fig. 29): Tegume e unco, em vista dorsal, com formato alongado, aquele com dois pequenos lóbulos laterais semipontiagudos e este largamente bífido como nas demais espécies de Iliana; combinação do braço ventral do tegume e do braço dorsal do saco fina; saco sem projeção anterior; gnato arredondado, não dividido e afastado do unco; fultura inferior com reentrância posterior; valva com a ampola larga e porção distal encoberta pela harpe alongada e direcionada dorsal- basalmente, esta terminando em ponta arredondada e denteada; edeago de comprimento menor que a altura do 9º segmento, porção ventral prolongada distalmente em processo com espinhos laterais; vesica com um a dois cornutos basais maiores e um conjunto de 13 cornutos distais menores.
O DNA barcode (Fig. 1) difere pouco do de I. peruvianus, no entanto as diferenças morfológicas são consideradas como diagnósticas para justificar a descrição da espécie.
Fêmea: Desconhecida.
Discussão: Pelos formatos do gnato e da valva, esta espécie sugere ser próxima de Iliana peruvianus. Todo seu aspecto é semelhante à I. peruvianus, mas difere pela coloração amarela mais clara, ao invés da tonalidade de ocre escuro, na face ventral da asa posterior, pela coloração amarela das franjas, ao invés de terem da mesma coloração das asas, e pela genitália masculina. Nesta, as diferenças são sutis e em função dos poucos exemplares disponíveis não se pode afirmar se constantes; em I. bolivianus a vesica tem 2 cornutos grandes basais e mais um conjunto de 13 menores e distais, o edeago termina em ponta ventral distinta e a harpe em ponta arredondada enquanto que em I. peruvianus são 3 cornutos basais e mais 11 distais, o edeago termina em ponta ventral não tão distinta e a harpe em ponta semiaguda. O que realmente diferencia imediatamente as duas espécies é a coloração das franjas e das áreas marginais nas asas posteriores: em I. bolivianus amarelo escuras incluindo uma fina área marginal (da largura das franjas) na face dorsal e outra similar na face ventral, enquanto que em I. peruvianus as franjas tem mesma coloração das asas, não há fina área marginal na face dorsal de coloração distinta e a coloração da área marginal da face ventral é ocre escura.
Fenologia: Os três exemplares foram coletados entre setembro, novembro e dezembro. Distribuição geográfica (Fig. 40): Bolívia, La Paz (Caranavi 600-1000 m) (OM).
Etimologia: O nome se refere ao país onde os exemplares foram coletados, Bolívia.
Iliana miersi Mielke & Casagrande, sp. nov. (Figs. 1, 6-9, 30, 37, 40)
Material tipo: Holótipo 1 com as seguintes etiquetas: /Holotypus/ 18-IV-1998 Cacatu, Antonina, PR [Paraná, Brasil, 20 m] O. Mielke leg. / Holotypus Iliana miersi Mielke & Casagrande. Mielke & Casagrande det. 2015/ OM 48.703 /. OM. Alótipo 0 com as seguintes etiquetas: / Allotypus / 18-IV- 1998 Cacatu, Antonina, PR [Paraná, Brasil, 20 m], O. Mielke leg./ Allotypus Iliana miersiMielke & Casagrande. Mielke & Casagrande det. 2015/ OM 48.984/. OM. Parátipos: 1 0, Rio de Janeiro, Brasil, OM 11.615 (sem abdome); OM. 1 fêmea 25-IV-1987, 1 1, 3 00, 18-IV-1998, 6 11, 2 00, 21-IV-1998 Cacatu, Antonina, Paraná, Brasil, O. Mielke leg., 10-20 m, OM 14.165, OM 48.695, OM 48.775, OM 48.687, OM 49.064, OM 48.576, OM 49.071, OM 48.639, OM 48.879, OM 48.983; OM 71.229, OM 48.975, OM 48.575, OM. 1 0, 18-IV-1998, 1 1, 21-IV-1998, Cacatu, Antonina, Paraná, O. Mielke leg. NHMUK. 1 0, 8-IV-1989, Matinhos, Paraná, Brasil, Mielke leg., 10 m, OM 21.796; OM. 1 1, 8-IV- 2000 Morro Alto, Morretes, Paraná, Brasil, 300 m, Mielke leg., OM 51.934; OM. 1 0, 14-IV-2013, Cedro, Antonina, Paraná, Brasil, Mielke & Callaghan leg., DZ 32.573; DZUP. 1 0, 18-IV-2013, Cedro, Antonina, Paraná, Brasil, Mielke, Siewert & Zacca leg., DZ 32.586; DZUP. 1 0, 15-IV-2013, Morretes, Paraná, Brasil, Mielke & Callaghan leg., DZ 32.570; DZUP. 2 11, 1 fêmea, Joinville, Santa Catarina, Brasil, OM 11.616, OM 11.617, OM 11.614; OM. 1 1, 18-III-1989, Joinville, Santa Catarina, Brasil, Miers & Mielke leg., OM 20.887; OM. 1 1, 1 0, 10-III-1973, Rio Natal, São Bento do Sul, Santa Catarina, Brasil, 500 m, Rank leg., OM 48.585, OM 48.577; OM. 1 0, 4-V-2009, Rio Natal, São Bento do Sul, Santa Catarina, Brasil, 500 m, Rank leg., DZ 22.613; DZUP.
Diagnose: Única espécie do gênero que possui a metade posterior da face ventral da asa posterior azul.
Descrição: Macho (Figs. 6, 7,30). Comprimento da asa anterior - 18,6-20 mm. Nudo com 26-28 artículos. Cabeça, tórax e abdome marrom, quase negro; com escamas azuis claras na parte anterior da linha de escamas entre as antenas, palpo ventralmente, mais esbranquiçado na porção de contato com os olhos, base da tégula, porção ventral do tórax, coxa, lado externo do fêmur, tíbia e tarso da perna protorácica, nos lados interno do fêmur e externo da tíbia na perna mesotorácica, nos lados interno do fêmur e externo da tíbia, do tarso na perna metatorácica e no abdome ventralmente, com exceção da linha mediana negra.
Face dorsal das asas marrom, quase negro, sendo o sexto marginal, desde o ápice até o ângulo anal, pouco mais claro; prega costal até Sc, com escamas ocre muito claro; franjas da mesma cor.
Face dorsal da asa posterior da mesma coloração da anterior, sendo a margem externa semelhante à da asa anterior, inclusive as franjas; área central pouco mais clara, deixando uma faixa discal fina e escura, discreta, entre Rs e CuA2-2A; área anal com escamas negras, finas, longas e eriçadas entre 2A e 3A; margem anal com poucas escamas azuis claras.
Face ventral da asa anterior da mesma coloração da face dorsal, com escamas mescladas de azul claro no ápice e no torno (podem ser poucas e isoladas), e margem interna levemente acinzentada, principalmente na base; franjas da mesma cor. Face ventral da asa posterior com margem costal e ápice da coloração geral, e o restante mesclado com escamas azuis claras, mais intensamente na área central até a margem anal, inclusive algumas franjas, entre as escuras.
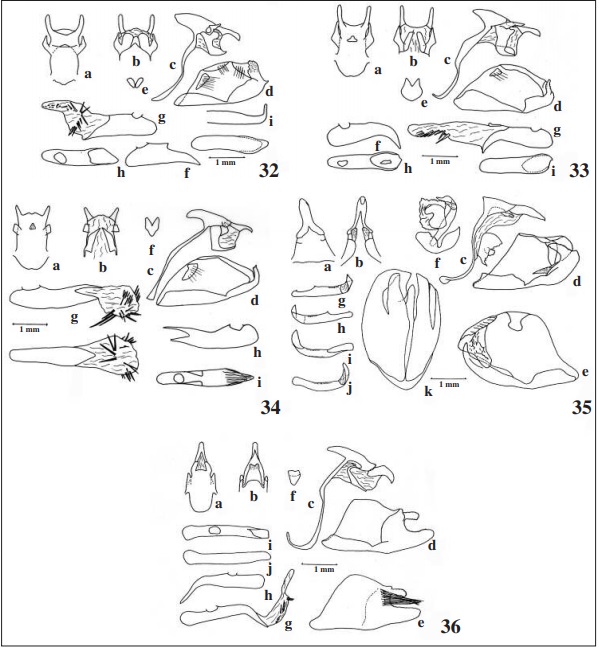
Genitália (Fig. 34): Tegume e unco, em vista dorsal, com formato alongado, aquele com pequenos lóbulos laterais e distais, e este largamente bífido, com o comprimento dos braços maiores que a distância entre eles na base; combinação do braço ventral do tegume e do braço dorsal do saco delgada; saco sem projeção anterior; gnato não dividido, afastado do unco, retangular com acentuada concavidade mediana distal; fultura inferior fracamente bilobada; valva com ampola alardada, contígua à harpe alargada, rombuda e não direcionada dorsalmente; edeago menor que o comprimento da valva, parte ventral prolongada em ponta distal larga e com pequeno espinho lateral direito, vesica com 6 cornutos distais e decrescentes em tamanho.
Fêmea (Figs. 8, 9,37): Comprimento da asa anterior - 20-21 mm. Semelhante ao macho, porém os desenhos da face dorsal das asas pouco mais marcados.
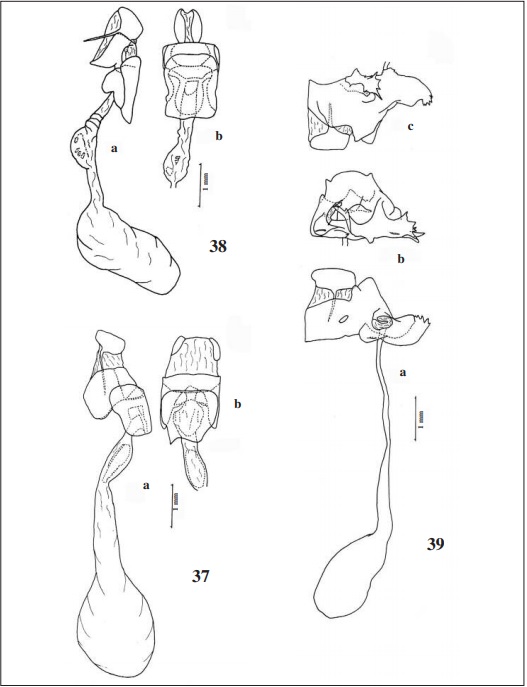
Genitália: Lamela antevaginal distinta e semiquadrada, sendo a porção proximal mais estreita e com pequena projeção basal pontuda no lado esquerdo; lamela pós-vaginal ampla, de margem posterior levemente sinuosa, sobressaindo um pouco da lamela antevaginal; duto da bolsa copuladora com estrutura esclerotinizada e alongada na parte basal, bolsa semiesférica e destacada.
Discussão: I. miersi é uma espécie, a julgar pela genitália masculina, próxima de I. remus, pois a harpe também é dirigida posteriormente, porém de formato diferente e cobrindo uma pequena porção basal da ampola, e o gnato em forma aproximada de uma placa transversal com reentrância mediana distal. A genitália feminina apresenta as lamelas antevaginal e pós-vaginal desenvilvidas, separadas e imbricadas, como em I. remus, as únicas espécies das quais se conhecem fêmeas.
Notas biológicas: Espécie escassa na floresta Atlântica entre o nível do mar e 500 m, razão de terem sido coletados somente os exemplares mencionados na lista do material estudado. Parte dos exemplares foi coletada sobre flores de Vernonanthura tweedieana (Baker) H. Rob. (Asteraceae), na parte da manhã, entre 9:00 e 11:00 horas. Machos e fêmeas pousam de asas abertas.
Fenologia: Até o momento e após 40 anos de trabalho de campo, somente é conhecida voando nos meses de março e maio, quando a referida planta floresce, no entanto, a espécie deve apresentar mais de uma geração por ano. Onde e quando observar exemplares nos outros períodos do ano continua um enigma.
Distribuição geográfica (Fig. 40): Brasil: Rio de Janeiro (Rio de Janeiro) (OM); Paraná (Antonina - IV, Matinhos - IV, Morretes - IV) (OM, DZUP) ; Santa Catarina (Joinville - III, São Bento do Sul – III, V) (OM, DZUP). Embora muitas coletas tenham sido realizadas por um dos autores no Brasil (OHHM), a sua ocorrência somente foi verificada nas encostas orientais dos estados do Rio de Janeiro, Paraná e Santa Catarina, mas deve ocorrer também no estado de São Paulo.
Etimologia: Iliana miersi é uma homenagem ao Sr. Herbert Miers (falecido em 22 de fevereiro de 2009), um dos mais competentes e dedicados coletores de lepidópteros de Joinville, Santa Catarina, Brasil, e que desde 1966 foi companheiro (OHHM) de dezenas de excursões nos arredores de Joinville, Santa Catarina e outros estados do Brasil. Uma pessoa extremamente humilde, leal e competente na procura de exemplares de lepidópteros para fins científicos, tanto de adultos como de imaturos. Criou quase todas as espécies de lepidópteros diurnos e muitos noturnos de sua cidade natal, razão porque conhecia quase todas as suas plantas alimentícias. Obter informações sobre lepidópteros de Joinville, certamente se tornou mais difícil.
Iliana remus Bell, 1937 (Figs. 1, 10-13, 31, 38, 41)
Iliana remus Bell, 1937. Amer. Mus. Novit., 914: 9, fig. 10 (genitália masculina); holótipo 1, Putumayo River, [Loreto], Perú; AMNH.– Evans, 1953. Cat. Amer. Hesp., .: 41, pl. 29 (genitália masculina).– Bridges, 1983. Lep. Hesp., .: 102; .: 17.– Bridges, 1988a. Cat. Hesp., .: 161; .: 28.– Bridges, 1994. Cat. Fam.-Group, Gen.-Group, Sp. Group Nam. Hesp. (Lep.) World, .: 193; .: 32.– Mielke, 2004. Hesperioidea: 49. In G. Lamas (ed.). Checklist: Part 4A, Hesperioidea-Papilionoidea. In J. B. Heppner (ed.). Atlas Neotrop. Lep. 5A.– Mielke, 2005. Cat. Amer. Hesperioidea, .: 594.– Mielke; Emery & Pinheiro, 2008. Revta bras. Ent., 52(2): 285.
(Sem gênero) remus; Beattie, 1976. Rhop. Direct.: 246.
Esta espécie foi descrita e sua genitália figurada com base em um exemplar, o holótipo macho de Putumayo River, Loreto, Perú, depositado no AMNH; o exemplar foi examinado. EVANS (1953) menciona um macho de La Merced, [Junín] Perú e MIELKE et al. (2008) a mencionam de Brasília, Distrito Federal, Brasil, todos os outros autores somente a citam em catálogos.
Ilustra-se o macho, a fêmea e as respectivas genitálias. Esta e as duas espécies que seguem são muito semelhantes externamente, com asas dorsalmente marrons, quase negras, e ventralmente de um marrom mais claro, algo acinzentado, e o ângulo anal da asa posterior normalmente mais claro ainda, às vezes com nuances azuis.
Diagnose: Pela coloração das asas, espécie muito semelhante a I. sapasoa, I. romulus . I. nirtoni, identificável pela genitália masculina, removendo simplesmente as escamas apicais do abdome e expondo a ponta da harpe. Única espécie com a harpe triangular e porção distal arredondada e não cobrindo parte adjacente da ampola. Normalmente os exemplares são menores que os de I. sapasoa . I. romulus, sendo o comprimento da asa anterior de 17-20 mm, enquanto que nestas de 17-21 mm e de 20-22 mm, respectivamente; no entanto, pode ter o mesmo comprimento de I. nirtoni - 17 mm.
Notas biológicas: É uma espécie que ocorre em florestas úmidas da parte ocidental da bacia amazônica, penetrando no Brasil até as florestas de galeria no Distrito Federal e Minas Gerais. Os exemplares coletados no Acre, Brasil, foram atraídos à iscas de papel higiênico umedecido com saliva humana (técnica de Ahrenholz - LAMAS et al., 1993).
Distribuição geográfica (Fig. 41): Perú: Loreto (Pebas - X, Río Putumayo (MUSM, AMNH); Junín (La Merced) (MUSM, AMNH, NHMUK). Guiana Francesa: Caiena (Montagnes des Chevaux - VI) (OM). Brasil: Acre (Bujari - VII, IX) (OM, DZUP); Amazonas: (Humaitá - IX) (OM); Maranhão (Caxias - Inhamum - IX) (CZMA); Distrito Federal (Brasília - Fazenda Água Limpa - I, VII, VIII) (DZUP); Minas Gerais (Corinto - X) (OM).
Iliana sapasoa (Nicolay, 1973), comb. n. (Figs. 1, 14-15, 32, 41)
Tosta sapasoaNicolay, 1973. Jour. Lep. Soc., 27: 245, figs. 3, 4, (1 d, v) 10, 10a (genitália masculina); holótipo 1, maio 1954, Sapasoa [recte Saposoa], 500 m, Río Huallaga, San Martín, Perú, Felix W[o]ytkowski leg.; AMNH.– Bridges, 1983. Lep. Hesp., .: 105; .: 38.– Bridges, 1988a. Cat. Hesp., .: 167; .: 63.– Bridges, 1994. Cat. Fam.-Group, Gen.-Group, Sp. Group Nam. Hesp. (Lep.) World, .: 200; .: 71.– Mielke, 2004. Hesperioidea: 57. InG. Lamas (ed.). Checklist: Part 4A, Hesperioidea-Papilionoidea. In J. B. Heppner (ed.). Atlas Neotrop. Lep. 5A.– Mielke, 2005. Cat. Amer. Hesperioidea, .: 756.
Esta espécie foi descrita e sua genitália figurada com base em um exemplar, o holótipo macho de Saposoa, Río Huallaga, San Martín, Perú, depositado no AMNH; o exemplar foi examinado. Todos os outros autores a mencionam em catálogos. O nome correto da localidade tipo é Saposoa.
Baseado em aspectos morfológicos da genitália masculina e de aspectos alares, Tosta sapasoa Nicolay, 1973 é aqui transferida para o gênero Iliana.
Diagnose: Pela coloração das asas, espécie semelhante a I. remus, I. romulus . I. nirtoni Mielke & Casagrande, sp. n., porém distinta pela genitália masculina.
Única espécie com uma projeção distal da harpe dobrada em ângulo de aproximadamente 90º para dentro da genitália e processo dorso-terminal da harpe alargado.
Notas biológicas: A julgar pelas procedências abaixo mencionadas, a espécie deve ocorrer em florestas úmidas das encostas orientais dos Andes no Perú e Bolívia.
Distribuição geográfica (Fig. 41): Perú: Huánuco (Tingo María - VIII, X) (OM); San Martín (Saposoa - Río Huallaga, Shanusi) (AMNH, OM). Bolívia: La Paz (Caranavi - VIII) (OM). Brasil: Acre (Mâncio Lima - Parque Nacional da Serra do Divisor - VIII) (DZUP).
Iliana romulus Bell, 1937 .Figs. 1, 16-17, 33, 42)
Iliana romulus Bell, 1937. Amer. Mus. Novit., 914: 9, fig. 2 (genitália masculina); holótipo 1, Río Putumayo, [Loreto], Perú; AMNH.– Evans, 1953. Cat. Amer. Hesp., .: 42.– Bridges, 1983. Lep. Hesp., .: 103; 2: 17.– Bridges, 1988a. Cat. Hesp., .: 163; 2: 28.– Bridges, 1994. Cat. Fam.-Group, Gen.- Group, Sp. Group Nam. Hesp. (Lep.) World, 7: 5; 8: p. 196; 9: 32.– Mielke, 2004. Hesperioidea: 49. In G. Lamas (ed.). Checklist: Part 4A, Hesperioidea-Papilionoidea. In J. B. Heppner (ed.). Atlas Neotrop. Lep. 5A.– Mielke, 2005. Cat. Amer. Hesperioidea, .: 594.
(Sem gênero) romulus; Beattie, 1976. Rhop. Direct.: 248.
Tosta capra Austin, 1999. Trop. Lep., ., Suppl. 2: 24, figs 5, 6 (1 d, v), 18 (genitália masculina); holótipo 1, 12-XI-1992, Fazenda Rancho Grande, Linha C-20, 7 km E B-65, 65 km S Ariquemes, Rondônia, Brasil, G. T. Austin leg.; DZUP.– Mielke, 2004. Hesperioidea: 57. InG. Lamas (ed.). Checklist: Part 4A, Hesperioidea-Papilionoidea. In J. B. Heppner (ed.). Atlas Neotrop. Lep. 5A.– Mielke, 2005. Cat. Amer. Hesperioidea, .: 756. Syn. n.
Tosta saltarana Steinhauser, 2007. Bull. Allyn Mus., 147: 3, figs 2 (1 d, v), 7 (genitália masculina); holótipo 1, V-1935, Juanjui, San Martín, Perú, ex coleção. E. Le Moult; McG. Syn. n.
Iliana romulus foi descrita e sua genitália figurada com base em um exemplar, o holótipo macho de Putumayo River, Loreto, Perú, depositado no AMNH; o exemplar foi examinado. EVANS (1953) a redescreve sem figurar a genitália. Tosta capra e Tosta saltarana também foram descritas baseadas em um exemplar cada uma, os holótipos machos de Cacaulândia (município recém estabelecido), Rondônia, Brasil (DZUP) e Juanjui, San Martín, Perú (McG), respectivamente. As demais referências a mencionam em catálogos.
Baseado no exame dos holótipos de Iliana romulus (AMNH) e Tosta capra Austin, 1999, syn. n. (DZUP) e na descrição de Tosta saltarana Steinhauser, 2007, syn. n., as últimas são sinonimizadas com a primeira, tendo em vista possuírem as mesmas características morfológicas.
Diagnose: Pela coloração das asas, espécie semelhante à I. remus, I. sapasoa . I. nirtoni, distinta destas pela genitália masculina. Única espécie com o processo dorso-terminal da harpe fino, encobrindo parte da ampola, e edeago com a porção distal curvada ventralmente.
Notas biológicas: É uma espécie que ocorre em florestas úmidas nas encostas orientais dos Andes do Perú e Brasil. O exemplar proveniente do Acre, Brasil, foi atraído e capturado em iscas de papel higiênico com saliva humana (técnica de Ahrenholz – LAMAS et al. 1993).
Distribuição geográfica (Fig. 42): Perú: Huánuco (Cordillera del Sira, Tingo María - VIII) (MUSM, OM); Loreto (Río Putumayo) (AMNH); San Martín (Juanjui - XI, Parque Nacional Cordillera Azul - X) (OM, MUSM). Brasil, Acre (Senador Guiomard - Reserva Catuaba - IX) (DZUP); Rondônia, Cacaulândia - XI) (DZUP).
Iliana nirtoni Mielke & Casagrande, sp. n. (Figs. 18-19, 34, 42)
Material tipo: Holótipo 1 com as seguintes etiquetas: / Holotypus / Brasil - RJ [Estado do Rio de Janeiro] Cach[oeiras]. de Macacu (Boca do Mato) 8-IV-1956, N. Tangerini col. / Gen[itália]. prep[arada]. Mielke 2014 / Ex coleção Nirton Tangerini / Holotypus Iliana nirtoni Mielke & Casagrande. Mielke & Casagrande det. 2015/ DZ 33.145/. DZUP.
Diagnose: Pela coloração das asas, espécie semelhante à I. remus, I. sapasoa . I. romulus, distinta pela genitália masculina. Única espécie com as apófises do tegume curtas e aproximadamente quadradas, e processo dorso-terminal da harpe fino e contíguo à ampola.
Descrição: Macho (Figs 18, 19, 34). Comprimento da asa anterior - 17 mm. Vértice, antenas, olhos, palpos, tórax, pernas externamente e abdome, inclusive ventralmente, marrons, quase negros; genas e pernas internamente pouco mais claras. Nudo com 25 artículos.
Asa anterior com prega costal até origem de R2 e com escamas amarelo claras. Face dorsal da asa anterior marrom escuro, com duas faixas difusas entre a costa e 2A, uma mediana passando pela célula discal junto às discocelulares, e outra submarginal; franjas da mesma cor.
Face dorsal da asa posterior da mesma coloração da asa anterior e também com duas faixas semelhantes às da asa anterior entre Rs e CuA2-2A, uma sub-basal e outra submarginal; franjas da mesma cor.
Face ventral da asa anterior da mesma coloração da face dorsal, com a margen anal finamente pouco mais clara; franjas da mesma cor. Face ventral da asa posterior com aproximadamente a metade anterior da mesma coloração da mesma face da asa anterior e a metade posterior pouco mais clara contendo as mesmas manchas difusas escuras da face dorsal; margem anal pouco mais clara; franjas da mesma cor.
Genitália (Fig. 34): Tegume e unco, em vista dorsal, retangulares, aquele com lóbulos laterais curtos, aproximadamente quadrados, e este largamente bífido, com o comprimento dos braços menores que a distância entre eles na base; combinação do braço ventral do tegume e do braço dorsal do saco estreita; saco sem projeção anterior; gnato dividido, com as pontas distais próximas; fultura inferior bilobada; valva com a ampola longa e estreita, e a ponta distal contígua à dobra estreita disto dorsal da harpe, esta com espinho distal; edeago do mesmo comprimento da valva, com a ponta distal bífida, um lóbulo dorsal com linhas longitudinais mais esclerotinizadas e outro ventral, ambos terminando de modo afilado, vesica com uma série de cornutos terminais de diversos tamanhos.
Discussão: I. nirtoni é uma espécie, a julgar pelos aspectos cromáticos e de genitália masculina, próxima de I. remus, I. sapasoa . I. romulus. Tem o mesmo comprimento alar dos exemplares menores de I. remus, mas a tonalidade da face ventral da asa posterior mais escura na parte do ângulo anal; pela genitália masculina se distingue pela presença de apófises aproximadamente quadradas e laterais do tegume, e pelo formato da harpe, possuindo uma ponta disto dorsal com espinho terminal. De I. sapasoa difere pelas apófises laterais do tegume aproximadamente quadradas, pelo gnato bífido, pelo formato da harpe, possuindo uma ponta disto dorsal delgada com espinho terminal, contígua à ampola e sem processo distal curvado para o interior da genitália e pelo edeago bilobado, sendo o processo dorsal maior que o ventral. De I. romulus difere também pelas apófises laterais do tegume aproximadamente quadradas, pelo formato da harpe possuindo uma ponta disto dorsal com espinho terminal e contígua à ampola e pelo edeago reto e bilobado, sendo o processo dorsal maior que o ventral.
Notas biológicas: Ocorre em floresta da mata Atlântica a uma altitude de 600 m, na localidade Boca do Mato, Cachoeiras de Macacu, na estrada para Nova Friburgo, Estado do Rio de Janeiro, Brasil.
Fenologia: Conhecida somente do mês de abril, mas certamente deve voar também em outros meses do ano.
Distribuição geográfica (Fig. 42): Brasil: Rio de Janeiro (Cachoeiras de Macacu, 600 m) (DZUP).
Etimologia: Iliana nirtoni é uma dedicatória ao nosso amigo Sr. Nirton Tangerini, companheiro de muitas coletas de borboletas desde 1957 e que doou a sua bela coleção ao Departamento de Zoologia, Universidade Federal do Paraná.
Austinus Mielke & Casagrande, gen. n.
Espécie tipo: Echelatus heros Mabille & Boullet, 1917, aqui designada.
A espécie tipo, única deste gênero, foi incluída em Iliana por EVANS (1953), no entanto, os caracteres não coincidem com os deste gênero, razão de ser estabelecido um novo. Em uma primeira vista, a única espécie incluída se assemelha pela configuração das asas e dos seus desenhos a Telemiades delalande (Latreille, [1824]), no entanto distingue-se imediatamente pelos palpos grandes e pontudos como nas espécies de Pellicia Herrich-Schäffer, 1870 e pela presença de escamas azuis no ângulo anal da face ventral da asa posterior.
Descrição: Asa anterior sem vestígios de veia recorrente na célula discal; apículo antenal mais curto que a parte da clava não recurvada da massa; antena metade do tamanho da costa; nudo com 29 - 32 artículos; haste antenal e massa terminal internamente amarelas; apículo antenal delgado e em gancho; palpos anormais, como nas espécies de Pellicia Herrich-Schäffer, 1870, ou seja, projetados para frente do olho por uma distância nitidamente maior que o diâmetro deste (em vista lateral) e inclinados ventralmente, em vista dorsal de aspecto cônico e paralelos, sendo o artículo distal destacado; célula discal da asa anterior mais curta que a margem interna; asa anterior sem ocelo negro na célula discal, sem prega costal e manchas semi-hialinas apicais; margem interna da asa posterior (base até a margem em 2A) 10% mais longa que a margem costal (base até a margem em Rs); tíbia mediana sem espinhos e com um par de esporões; pernas posteriores com dois pares de esporões; genitália masculina assimétrica, sendo a valva esquerda maior que a direita, quase encaixando nesta; unco não dividido, em vista lateral aproximadamente reto e em vista dorsal levemente curvado para a direita; gnato dividido em dois lóbulos alongados, muito pequenos, separados e alojados sob a parte distal do tegume e da parte proximal do unco; valva direita com a ampola larga, arredondada com a margem dorsal curvada para dentro da genitália e harpe expandida dorsalmente sobre a ampola; valva esquerda com a costa curta e projetada ventralmente, ampola larga, margem dorso-distal curvada para dentro e com rugosidades, harpe estreita, curta e curvada dorsalmente; edeago delgado, aproxima- damente do comprimento do tegume + unco, com pontuações dorso laterais antes da abertura distal, com a ponta distal aberta dorsalmente e curvada para a esquerda, vesica sem cornutos, abertura do bulbo ejaculatório ampla, quase ocupando 1/3 do comprimento do edeago; fultura inferior com aspecto de barra transversal com reentrância dorsal, fultura superior bem esclerotinizada, em vista posterior como um anel aproximadamente quadrado que desloca o edeago para o lado direito; genitália feminina com o oitavo segmento totalmente esclerotinizado e com as lamelas ante e pós-vaginais totalmente fundidas, apresentando ventralmente expansões bizarras com espinhos; óstio em fenda e deslocado para o lado esquerdo.
O DNA barcode (Fig. 1) mostra uma grande diferença em relação às espécies de Iliana. Etimologia: O nome é uma dedicatória ao nosso amigo Dr. George Austin, McGuire Center for Lepidoptera and Biodiversity, Universiry of Florida, Gainesville, Florida, USA, grande conhecedor dos Hesperiidae neotropicais, falecido em 30 de junho de 2009.
Austinus heros (Mabille & Boullet, 1917), comb. n.
Austinus heros heros (Mabille & Boullet, 1917), comb. n. (Figs 1, 20-23, 35, 39, 43)
Echelatus heros Mabille & Boullet, 1917. Bull. Soc. ent. Fr., 1916: 324; 1 0, Guiana Francesa,
MNHN, 2 11, Perú, MNHN (coleção Boullet).– Shepard, 1934. Lep. Cat., 64: 179.
Iliana heros heros; Evans, 1953. Cat. Amer. Hesp., .: 41, pl. 29 (genitália mascullina).– Lamas, 1981. Rev. Soc. Mex. Lep., .: 36.– Bridges, 1983. Lep. Hesp., .: 52; 2: 17.– Bridges, 1988a. Cat. Hesp., .: 83; .: 28.– Lamas, 1994. In Foster et al. RAP Working Papers, .: 174.– Bridges, 1994. Cat. Fam.- Group, Gen.-Group, Sp. Group Nam. Hesp. (Lep.) World, .: 99; .: 32.– Lamas; Campos & Ramírez. 2003. Marip. Zona Res. Allpahuayo-Mishana, Iquitos: 9, 16, fig. (male d).– Mielke, 2004. Hesperioidea: 49. In G. Lamas (ed.). Checklist: Part 4A, Hesperioidea-Papilionoidea. In J. B. Heppner (ed.). Atlas Neotrop. Lep. 5A.– Mielke, 2005. Cat. Amer. Hesperioidea, .; 594.– Gareca et al., 2006. In Gareca & Reichle. Marip. diurn. Bolivia: 16.– Mielke; Carneiro & Casagrande, 2012. Acta Amaz., 42(2): 254.
(Sem gênero) heros; Beattie, 1976. Rhop. Direct.: 159.
Anastrus sempiternus [erro de identificação]; Garwood et al., 2007. Butt. South. Amaz.: 196, fig. (v).
Iliana heros; Garwood et al., 2009.Butt. South. Amaz., .nd ed.: 289, figs (d, v).
A espécie foi descrita por MABILLE & BOULLET (1917) e redescrita por EVANS (1953), sendo
todas as demais referências em catálogos ou listas de distribuição geográfica de espécies.
Somente o macho foi figurado em vista dorsal por LAMAS et al. (2003) e em vistas dorsal e ventral por GARWOOD et al. (2007, 2009). Aqui é figurado novamente, inclusive a fêmea e a genitália de ambos os sexos.
Para assegurar a correta identificação de Echelatus heros Mabille & Boullet, 1917, um síntipo macho é aqui designado como lectótipo; este exemplar tem as seguintes etiquetas: / Type / E. heros Mab. et Boull. / Echelatus heros Mab. - Boull. Bull. Soc. ent. Fr., 1916 (1917): 324 / Cuzco Pérou 3000-1907 Herm[ann]. Rolle Coll. Boull. Museum Paris/; outras duas etiquetas serão enviadas ao curador da instituição para que sejam colocadas no exemplar: / Lectotypus / Lectotypus Echelatus herosMabille & Boullet, 1917. O. Mielke & Casagrande det. 2015. / MNHN.
Distribuição geográfica (Fig. 43): Colômbia: Meta (Campamento Casagrande - VII) (LCRO). Perú: Amazonas (Cordillera del Cóndor - Falso Paquisha - X) (MUSM); Cuzco (Llavero [recte Yavero] - IX) (MUSM); Huánuco (Pachitea, Tingo María - VIII, X, XI) (OM); Loreto (Allpahuayo-Mishana - III, Iquitos, Zona Reservada Sierra del Divisor – Puerto Venus - III) (NHMUK, MUSM); Madre de Dios (Puerto Maldonado - 100 km L - XI, Quebrada Agua Negra – VIII, Tambopata) (OM, MUSM); Puno (Carabaya - San Gabán, Chaquimayo, Parque Nacional Bahuaja Sonene - IX) (NHMUK, MUSM). Bolívia: La Paz (Caranavi - I, II, III, VIII, IX, X, XI, XII, Río Songo, Sarampiuni) (NHMUK, OM). Venezuela: Amazonas (Yavita - IX) (OM). Guiana Francesa (MNHN). Brasil: Amazonas (Humaitá - VII, São Paulo de Olivença) (OM); Acre (Mâncio Lima - Parque Nacional da Serra do Divisor - VI, IX); Pará (Acará - XII, Óbidos, Santo Antônio do Tauá - II, X) (DZUP, OM); Rondônia (Candeias do Jamari - VII, IX, Porto Velho - IX, Vilhena - IX, X, XI) (OM, DZUP); Mato Grosso (Pantanal) (ZUEC).
Austinus heros heroica Evans, 1953, comb. n. (Figs. 24-25, 43)
Iliana heros heroica Evans, 1953. Cat. Amer. Hesp., .: 40; [holó]tipo 1, Río Dagua, Colombia, W. Rosenberg leg.; NHMUK.– Bridges, 1983. Lep. Hesp., .: 52; .:. 17.– Bridges, 1988a. Cat. Hesp., .: 83; .: 28.– Bridges, 1994. Cat. Fam.-Group, Gen.-Group, Sp. Group Nam. Hesp. (Lep.) World, .: 99; .: 32.– Mielke, 2004. Hesperioidea: 49. In G. Lamas (ed.). Checklist: Part 4A, Hesperioidea- Papilionoidea. In J. B. Heppner (ed.). Atlas Neotrop. Lep. 5A.– Mielke, 2005. Cat. Amer. Hesperioidea, .: 594.
(No genus) heroica; Beattie, 1976. Rhop. Direct.: 159.
A subespécie foi descrita por EVANS (1953), sendo todas as demais referências em catálogos.
Nunca foi ilustrada, razão de figurar o holótipo. A fêmea é desconhecida.
Distribuição geográfica (Fig. 43): Colômbia: Valle del Cauca (Río Dagua) (NHMUK); Ecuador: Imbabura (Hacienda Paramba) (NHMUK).
Emmelus Mielke & Casagrande, gen. n.
Espécie tipo: Telemiades purpurascens Mabille & Boullet, 1912, aqui designada.
A espécie tipo, única deste gênero, foi incluída em Iliana por EVANS (1953), no entanto, os caracteres não coincidem com os deste gênero, razão de ser estabelecido um novo. Em uma primeira vista se assemelha pela configuração das asas e dos seus desenhos alares a uma espécie de Telemiades Hübner, [1819], do grupo de Telemiades nicomedes(Möschler, 1879), no entanto as faces alares são mais escuras, quase negras, e os palpos e as coxas protorácicas amarelas.
Descrição: asa anterior sem vestígios de veia recorrente na célula discal; apículo antenal mais curto que a porção da clava não recurvada; antena metade do comprimento da costa; nudo com 31-32 artículos; haste e massa terminal da antena internamente amarelas; apículo antenal delgado, em gancho; palpo como nas espécies de Telemiades, ou seja, projetado para frente por uma distância menor que o diâmetro do olho (em vista lateral) e não inclinado ventralmente, em vista dorsal arredondados; célula da asa anterior menor que a margem interna; asa anterior sem ocelo negro na célula (face dorsal) e sem dobra costal, com duas ou três manchas semi-hialinas apicais; asa posterior com a margem anal (base até o término de 2A) 10% maior que a margem costal (base ao término de Rs); tíbia mesotorácica sem espinhos e com um par de esporões; perna metatorácica com dois pares de esporões; genitália masculina simétrica; tegume com dois pequenos lóbulos laterais não atingindo o unco, este não dividido e curvado ventralmente em vista lateral; gnato único, afastado do unco, semiretangular e estreitando para a porção distal ligeiramente bilobada; valva com a ampola e a harpe aproximadamente paralelas, esta pouco maior e mais espessa; valva, no lado externo, com um conjunto de cerdas longas entre a ampola e harpe; edeago estreito, liso, nitidamente maior que o comprimento do tegume + unco, ponta distal curvada para baixo em aproximadamente 45º; vesica com um conjunto de cornutos basais e mais dois cornutos destacados no meio; fultura inferior semitrangular.
O DNA barcode (Fig. 1) mostra uma grande diferença em relação às espécies de Iliana.
Etimologia: O nome é uma dedicatória ao nosso amigo Dr. Thomas C. Emmel, diretor e idealizador do McGuire Center for Lepidoptera and Biodiversity, University of Florida, Gainesville, Florida, USA (McG), um dos mais expressivos institutos dedicados ao estudo dos Lepidoptera.
Emmelus purpurascens(Mabille & Boullet, 1912), comb. n. (Figs. 1, 26-27, 36, 44)
Telemiades purpurascensMabille & Boullet, 1912 (Herrich-Schäffer, in litt.). Ann. Sc. nat., Zool., Paris, (9)16: 118, 121; 1 1 [holótipo], Brasil; coleção Herrich-Schäffer.– Draudt, 1922. InA. Seitz.
Gross-Schmett. Erde, .: 869.– Shepard, 1931. Lep. Cat., 47: 79.
Iliana purpurascens; Evans, 1953. Cat. Amer. Hesp., .: 41, pl. 29 (genitália masculina).– Bridges, 1983. Lep. Hesp., .: 99; .: 17.– K. Brown, 1987. An. Prim. Simp. Pantanal, Brasília: 167.– Bridges, 1988a. Cat. Hesp., .: 157; .: 28.– Bridges, 1994. Cat. Fam.-Group, Gen.-Group, Sp. Group Nam.
Hesp. (Lep.) World, .: 188; .: 32.– Robbins et al., 1996. In Wilson & Sandoval. Manu: 246.– Lamas; Campos & Ramírez. 2003.Marip. Zona Res. Allpahuayo-Mishana, Iquitos: 9.– Mielke, 2004. Hesperioidea: 49. In G. Lamas (ed.). Checklist: Part 4A, Hesperioidea-Papilionoidea. In J. B. Heppner (ed.). Atlas Neotrop. Lep. 5A.– Mielke, 2005. Cat. Amer. Hesperioidea, .: 594.
(Sem gênero) purpurascens; Beattie, 1976. Rhop. Direct.: 243.
Espécie foi descrita por MABILLE & BOULLET (1912), redescrita por DRAUDT (1922) e EVANS (1953), sendo todas as demais referências em catálogos ou listas de espécies. As quatro referências em MIELKE (2005) de Telemiades purpurascens atribuidas a HAYWARD (1947, 1948, 1973) e BIEZANKO & MIELKE (1973) devem se referir a Telemiades squanda Evans, 1953, razão de terem sido aqui removidas.
O [holótipo] não foi encontrado no ZMHU, onde está a coleção Herrich-Schäffer, mencionada na descrição original. Para garantir a correta identificação de Telemiades purpurascens Mabille & Boullet, 1912, mencionado como Iliana purpurascens por EVANS (1953), um neótipo é aqui designado; este exemplar possui as seguintes etiquetas: / Neotypus / 18-20-IX-2003, 50KM NO Bujari, Acre, [Brasil], 200 m, O.-C. Mielke & Casagrande leg. / Gen[itália]. Prep[arada] O. Mielke 2015 / Neotypus Telemiades purpurascens Mabille & Boullet, 1912. Mielke & Casagrande det. 2015 / BC-DZ [barcoded Departamento de Zoologia] / DZ 15.572 /. DZUP. A designação do neótipo se faz necessária para evitar qualquer dúvida na identificação do táxon, uma vez que muitas espécies de Telemiades Hübner, [1819], como T. litanicus(Hewitson, 1876), T. meris meris (Plötz, 1886), T. meris brazus Bell, 1949, T. nicomedes (Möschler, 1879), T. sila Evans, 1953, T. squanda Evans, 1953, T. trenda Evans, 1953, T. vansa Evans, 1953 e outras espécies novas em estudo e muito semelhantes nos seus aspectos cromáticos (SIEWERT et al., em preparação). A localidade tipo de Telemiades prupurascens, mencionada como Brasil, é muito vaga e com a designação do neótipo ela passa a ser Brasil, Acre, Bujari. Telemiades squanda foi no mínimo identificada quatro vezes como sendo I. purpurascens, como mostrado no parágrafo anterior, fato que mostra a necessidade desta designação.
Somente a genitália masculina desta espécie foi figurada por EVANS (1953), razão do macho ser aqui figurado, inclusive com outro desenho da genitália masculina. A fêmea é desconhecida.
Notas biológicas: Pelos registros abaixo, nota-se que a espécie é amplamente distribuída na bacia amazônica. Os machos pousam de asas abertas em areias úmidas na beira de pequenos rios dentro de florestas.
Distribuição geográfica (Fig. 44): Venezuela: Amazonas (San Carlos - III, Yavita - IX) (OM). Perú: Cuzco (Poyentinari - IX) (MUSM); Huánuco (Tingo María - II, X, XI) (OM); Junín (Chanchamayo, Perené) (NHMUK, OM); Loreto (Iquitos, Pebas, Picuroyacu - X, Zona Reservada Allpahuayo-Mishana - XI) (NHMUK, MUSM, DZUP); Madre de Dios (Alto Río Madre de Dios - aproximadamente 1,5 KM a NO de Atalaya, Cuzco - Albergue Amazonia - IV, V, X, XI, Parque Nacional del Manu - X) (OM, DZUP, MUSM); Puno (Zona Reservada Tambopata-Candamo - III) (MUSM); San Martín (Juanjui - V, VIII, Tarapoto) (OM); Brasil: Acre (Bujari - VII, IX, Mâncio Lima - Parque Nacional da Serra do Divisor - VI, VIII, Porto Acre - Reserva Humaitá- IX, Senador Guiomard - Reserva Catuaba - IX) (OM, DZUP); Rondônia (Cacaulândia - VII, Candeias do Jamari - VII) (OM); Mato Grosso (Pantanal) (ZUEC); São Paulo (Casabranca - localidade duvidosa) (OM).



Agradecimientos
Aos Drs. Rodolphe Rougerie, Muséum National d’Histoire Naturelle, Paris, França e Paul Hebert, Canadian Centre for DNA Barcoding, Biodiversity Institute of Ontario, University of Guelph, Guelph, Ontario, Canadá, pela gentileza em obter os barcodes das espécies aqui estudadas. Aos Drs. Frederick
1. Rindge e James S. Miller, American Museum of Natural History, New York, USA, pela permissão oferecida para estudar os Hesperiidae desta instituição. Aos Drs. Richard I. Vane-Wright e Phillip R. Ackery do The Natural History Museum, London, UK, pela permissão oferecida para estudar os Hesperiidae desta instituição. Ao Dr. Helder Ferreira Morato, Departamento de Ciências da Natureza, Universidade Federal do Acre, Rio Branco, Acre, Brasil, pela permissão dada aos autores para estudar os lepidópteros nas Reservas de Catuaba, Senador Guiomard e da Reserva Humaitá, Porto Acre, da Universidade Federal do Acre, Rio Branco, Acre, Brasil. Aos Srs. José Eduardo de Moura Leite e Frederico Lemos de Moura Leite que gentilmente permitiram coletar lepidópteros em suas propriedades em Bujari, Acre, Brasil, de onde provém alguns exemplares aqui estudados. Ao Dr. Eduardo de Oliveira Emery, Conselho Nacional de Desenvolvimento Científico e Tecnológico, Brasília, Brasil e Bernard Hermier, Remire Montjoly, French Guiana, pela doação de exemplares de Iliana remus, e ao Sr. Ivo Rank, São Bento do Sul, Santa Catarina, Brasil pela doação de exemplares de I. miersi. Ao Sr. Claudionor Elias, tecnologista do Departamento de Zoologia, Universidade Federal do Paraná, pela coleta de exemplares de Iliana remus. Ao Dr. Armando Cervi, Departamento de Botânica, Universidade Federal do Paraná, Curitiba, Paraná, Brasil, pela identificação da planta em cujas flores foram capturados os exemplares de Iliana miersi. Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pela concessão de bolsas de produtividade aos autores.
BIBLIOGRAFIA
AUSTIN, G. T., 1999.– Hesperiidae of Rondônia, Brazil: Anastrus and Tosta, with descriptions of two new species (Lepidoptera: Hesperiidae: Pyrginae).– Tropical Lepidoptera, ., Suppl. 2: 19-25.
BEATTIE, J. R., 1976.– The Rhopalocera Directory: 14+365 pp. JB Indexes, Berkeley.
BELL, E. L., 1937. New genera and species of Neotropical Hesperiidae with notes on some others (Lepidoptera; Rhopalocera).– American Museum Novitates, 914: 1-17
BIEZANKO, C. M. & MIELKE, O. H. H., 1973.– Contribuição ao estudo faunístico dos Hesperiidae americanos. IV Espécies do Rio Grande do Sul, com notas taxonômicas e descrições de espécies novas (Lepidoptera).– Acta Biológica Paranaense, .(1-4): 51-102.
BRIDGES, C. A., 1983.– Lepidoptera: Hesperiidae. Notes on species-group names: 2 pp.; Part 1, 129 pp.; Part 2, 41 pp.; Part 3, 62 pp.; Part 4, 30 pp.; Part 5, 13 pp. Edição do autor, Urbana
BRIDGES, C. A., 1988a.– Catalogue of Hesperiidae (Lepidoptera: Rhopalocera): VII pp.; Part .: 205 pp.; Part .: 67 pp.; Part .: 78 pp.; Part .: 54 pp.; Part .: 20 pp.; Part .: 7 pp.; App. .: 1 p.; App. .: 8 pp.; Annot. .: 1 p.; Annot. .: 1 p.; Annot. .: 4 pp.; Annot. .: 2 pp.; Annot. .: 6 pp. Edição do autor, Urbana.
BRIDGES, C. A., 1988b.– Catalogue of family-group and genus-group names (Lepidoptera: Rhopalocera). Part .: 8 pp.; Part .: 3 pp.; Part .: 4 pp.; Part .: 141 pp.; Part .: 33 pp.; Part .: 68 pp.; Part .: 18 pp.; Part .: 61 pp.; Part .: 20 pp.; Part 10: 8 pp. Edição do autor, Urbana.
BRIDGES, C. A., 1994.– Catalogue of the family-group, genus-group and species-group names of the Hesperioidea (Lepidoptera) of the world: XII pp.; Part .: 1 p.; Part .: 1 p.; Part .: 1 p.; Part .: 36 pp.; Part .: 9 pp.; Part .: 20 pp.; Part .: 6 pp.; Part .: 246 pp.; Part .: 76 pp.; Part 10: 90 pp.; Part 11: 71 pp.; Part 12: 28 pp.; Part 13: 9 pp.; App. .: 1 p.; App. .: 2 pp.; App. .: 1 p. Edição do autor, Urbana.
BROWN JR., K. S., 1987.– Zoogeografia da região do Pantanal Mato-Grossense.– Anais do 1º Simpópsio sobre Recursos Naturais e Sócio-Econômicos do Pantanal: 137-178. EMBRAPA, Brasília.
DEVRIES, P., AUSTIN, G. T. & MARTIN, N. H., 2008.– Diel activity and reproductive isolation in a diverse assemblage of Neotropical skippers (Lepidoptera: Hesperiidae).– Biological Journal of the Linnean Society, 94: 723-736.
DRAUDT, M. W. K., 1921-1924.– B. Grypocera, breitköpfige Tagfalter.– In A. SEITZ (ed). Die Gross- Schmetterlinge der Erde, .: 836-1011, pls. 160-191. Stuttgart, Alfred Kernen.
EVANS, W. H., 1953.– A catalogue of the American Hesperiidae indicating the classification and nomenclature adopted in the British Museum (Natural History). Part III. Pyrginae. Section 2: V + 246 pp. British Museum (Natural History), London.
GARWOOD, K., LEHMAN, R., CARTER, W. & CARTER, G., 2007.– Butterflies of the Southern Amazonia. A photographic checklist of common species: VIII + 274 pp. McAllen, Edition RiCalé Publishing, Texas
GARWOOD, K., LEHMAN, R., CARTER, W. & CARTER, G., 2009.– Butterflies of the Southern Amazonia. A photographic checklist of common species. 2nd. Edition: VIII + 374 pp. McAllen, Edition RiCalé Publishing, Texas.
GARECA, Y., FORNO, E., PYRCZ, T., WILLMOTT, K. & REICHLE, S., 2006.– Lista preliminar de mariposas diurnas de Bolivia, pp. 5-65. In. Y. GARECA & S. REICHLE. Mariposas diurnas de Bolivia: 108 pp. Prometa, Tarija
HAYWARD, K. J., 1947.– Hesperioidea argentina XVI.– Acta zoologica lilloana, .: 5-18.
HAYWARD, K. J., 1948.– Genera et Species Animalium Argentinorum 1, Insecta, Lepidoptera (Rhopalocera), familia Hesperiidarum, subfamiliae Pyrrhopyginarum et Pyrginarum: 389 pp., 27 pls. Guillermo Kraft, Buenos Aires.
HAYWARD, K. J., 1973.– Catálogo de los ropalóceros argentino.– Opera lilloana, 23: 1-318.
HEMMING, A. F., 1967.– The generic names of the butterflies and their type-species (Lepidoptera: Rhopalocera).– Bulletin of the British Museum of Natural History (Entomology), Supplement , .: 1-509.
CÓDIGO INTERNACIONAL DE NOMENCLATURA ZOOLÓGICA, 1999.– Cuarta Edición, adoptada por la Unión Internacional de Ciencias Biológicas, 2000: XXIX + 156 pp. The International Trust for Zoological Nomenclature, Madrid.
JANZEN, D, H.; HALLWACHS, W. & BURNS, J. M., 2010.– A tropical horde of counterfeit predator eyes.– Proceedings of the National Academy of Sciences, 107(26): 11659-11665, Table S1, Figs. S1-S14.
LAMAS, G., 1969.– Lista de Ropalóceros (Lepidoptera) peruanos citados en la obra “Die Gross-Schmetterlinge der Erde” de Adalbert Seitz.– Biota, .(58): 265-354.
LAMAS, G., 1981.– La fauna de mariposas de la Reserva de Tambopata, Madre de Dios, Perú (Lepidoptera, Papilionoidea y Hesperioidea).– Revista de la Sociedad mexicana de Lepidopterologia, .(2): 23-40.
LAMAS, G., CAMPOS, L. & RAMÍREZ, J. J., 2003.– Mariposas de la Zona Reservada Allpahuayo-Mishana, Iquitos, Loreto, Perú (Lepidoptera: Hesperioidea y Papilionoidea): 29 pp. Programa de Biodiversidad (PBIO) - Instituto de Investigaciones de la Amazonia Peruana (IIAP), Loreto.
LAMAS, G.; MIELKE, O. H. H. & ROBBINS, R. K., 1993.– The Ahrenholz technique for attracting tropical skippers.– Journal of the Lepidopterists’ Society, 47(1): 80-82, 1 fig.
MABILLE, P., 1883.– Description d’hespéries.– Annales de la Société entomologique de Belgique, 27, Comptes- rendu: 51-78.
MABILLE, P., 1903-1904.– Lepidoptera Rhopalocera. Fam. Hesperidae.– In P. WYTSMAN. Genera Insectorum, 17: 210 pp., 4 pls.,V. Verteneuil & L. Desmet, Bruxelas.
MABILLE, P. & BOULLET, E., 1912.– Essai de révision de la famille des hespérides. Annales des Sciences naturelles (Zoologie), (9)16: 1-159.
MABILLE, P. & BOULLET, E., 1917.– Description d’hespérides nouveaux (Lep. Hesperiinae, Sect. B).– Bulletin de la Société entomologique de France, 1916(1917): 320-325.
MABILLE, P. & BOULLET, E., 1919.– Essai de révision de la famille des hespérides.– Annales des Sciences naturelles (Zologie), (10).: 199-258.
MABILLE, P. & VUILLOT, P., 1890-1895. Novitates lepidopterologicae, 1-10: 161 pp., 22 pls. Paul Vuillot, Paris.
MIELKE, O. H. H., 2004.– Hesperioidea, Hesperiidae: 3-11, 25-86.– In G. LAMAS (ed.). Checklist: Part 4A, Hesperioidea - Papilionoidea.– In J. B. HEPPNER (ed.). Atlas of Neotropical Lepidoptera, Vol. 5A: 35 + 439 pp. Association of Tropical Lepidoptera, Scientific Publishers, Gainesvillle, Washington, Hamburg, Lima, Taipei, Tokyo.
MIELKE, O. H. H., 2005.– Catalogue of the American Hesperioidea: Hesperiidae (Lepidoptera). Pyrginae 2, Pyrgini, .: 413-771. Sociedade Brasileira de Zoologia, Curitiba.
MIELKE, O. H. H., EMERY, E. DE O. & C. PINHEIRO, C. E. G., 2008.– As borboletas Hesperiidae (Lepidoptera, Hesperioidea) do Distrito Federal, Brasil.– Revista Brasileira de Entomologia, 52(2): 283-288.
MIELKE, O. H. H., CARNEIRO, E. & CASAGRANDE, M. M., 2012.– Os Hesperiidae (Lepidoptera, Hesperioidea) da RPPN Klagesi, Santo Antônio do Tauá, Pará, Brasil: nova contribuição para o conhecimento da biodiversidade da área de endemismo Belém.– Acta Amazonica, 42(2): 251-258.
NICOLAY, S. S., 1973.– Descriptions of new Neotropical Hesperiidae.– Journal of the Lepidopterists’ Society, 27(4): 243-257.
ROBBINS, R. K.; LAMAS, G., MIELKE, O. H. H., HARVEY, D. J. & CASAGRANDE, M. M., 1996.– Taxonomic compositioin and ecological structure of the species-rich butterfly community at Pakitza, Parque Nacional del Manu, Perú, pp. 217-252. In D. E. WILSON & A. SANDOVAL. Manu. The Biodiversity of Southeastern Peru / La Biodiversidad del Sureste del Perú: 679 pp. Smithsonian Institution, Washington.
SHEPARD, H. H., 1931.– Hesperiidae: Subfamilia Pyrginae.– Lepidopterorum Catalogus, 47: 1-144.
SHEPARD, H. H., 1934.– Hesperiidae: Subfamilia Pyrginae.– Lepidopterorum Catalogus, 64: 145-272.
SHEPARD, H. H., 1944.– The types of hesperioid genera. Further additions and corrections to the Lindsey list.– Annals of the entomological Society of America, 36(4): 754-760.
STEINHAUSER, S. R., 2007.– Four new species of Neotropical skippers.– Bulletin of the Allyn Museum, 147: 1-11.
WARREN, A. D., OGAWA, J. R. & BROWER, A. V. Z., 2008.– Phylogenetic relationship of subfamilies and circumscription of tribes in the family Hesperiidae (Lepidoptera: Hesperioidea).– Cladistics, 24: 1-35.
WARREN, A. D., OGAWA, J. R. & BROWER, A. V. Z., 2009.– Revised classification of the family Hesperiidae (Lepidoptera: Hesperioidea) based on combined molecular and morphological data.– Systematic Entomology, 34: 467-523