

Borboletas frugívoras em Florestas de Mata Atlântica do Parque Nacional do Iguaçu, Paraná, Brasil (Lepidoptera: Nymphalidae)
Fruit-feeding butterflies in Atlantic forests of Iguassu National Park, Parana, Brazil (Lepidoptera: Nymphalidae)
Mariposas frugívoras en el bosque Atlántico del Parque Nacional de Iguazú, Paraná, Brasil (Lepidoptera: Nymphalidae)
Borboletas frugívoras em Florestas de Mata Atlântica do Parque Nacional do Iguaçu, Paraná, Brasil (Lepidoptera: Nymphalidae)
SHILAP Revista de lepidopterología, vol. 44, núm. 173, 2016
Sociedad Hispano-Luso-Americana de Lepidopterología
Recepción: 11 Junio 2014
Aprobación: 01 Octubre 2014
Resumo: Borboletas frugívoras, facilmente coletadas através de armadilhas com isca atrativa, podem ser utilizadas em estudos ecológicos comparativos, através de protocolo de amostragem. Desta forma, o presente estudou buscou comparar as assembleias de borboletas frugívoras quanto à abundância, riqueza e composição das espécies em duas fitofisionomias de Mata Atlântica do Parque Nacional do Iguaçu: Floresta Estacional Semidecídua (FES) e Floresta Ombrófila Mista (FOM). Para isso, foram realizadas amostragens mensais entre novembro de 2012 e maio de 2013 através de armadilhas atrativas do tipo Van Someren-Rydon com isca constituída de banana amassada fermentada em caldo de cana. Em cada fitofisionomia, utilizaram-se 15 armadilhas em transectos pré-definidos, revisadas a cada 24 h ao longo de cinco dias por ocasião amostral. Ao final de seis amostragens e 900 armadilhas/dia de esforço total foram registrados 1.127 indivíduos pertencentes a 69 espécies e 4 subfamílias de borboletas frugívoras. Satyrinae foi subfamília mais abundante e com maior riqueza de espécies. Considerando a abundância das espécies, 604 (52,54% dos indivíduos) foram amostrados em FES, enquanto 523 (47,46%) em FOM. A análise de rarefação apresentou maior riqueza significativa de espécies em FES, com 65 espécies observadas, enquanto FOM apresentou 55. As curvas de acúmulo de espécies não atingiram a assíntota para cada uma das fitofisionomias. Da mesma forma, os estimadores analíticos de riqueza Jacknife 1 e Bootstrap calculados apresentaram valores superiores à riqueza amostrada para ambas as áreas indicando que mais espécies poderiam ser observadas com aumento de esforço amostral. Trinta e oito espécies constituíram novos registros para o Parque Nacional do Iguaçu. Apenas uma espécie em cada fitofisionomia foi dominante, sendo Memphis moruus stheno (Prittwitz, 1865) em FES e Pareuptychia summandosa (Gosse, 1880) em FOM. Os resultados aqui obtidos demonstram que a guilda de borboletas frugívoras do Parque Nacional do Iguaçu apresenta composição e riqueza de espécies expressivas. Além disso, aliados aos demais estudos locais e regionais, podem gerar informações para a conservação e manejo de áreas reservadas para a proteção de biodiversidade.
Palavras-chave: Lepidoptera, Nymphalidae, conservação, diversidade, inventário, riqueza de espécies, Brasil.
Abstract: Fruit-feeding butterflies easily collected with attractive bait traps can be used in comparative ecological studies through sampling protocol. Thus, the present study is aimed at comparing the fruit-feeding butterfly assemblages of two Atlantic forest phytophysiognomies in Iguassu National Park: Semideciduous forest (FES) and Araucaria forest (FOM) in relation to abundance, richness and species composition. Field work was carried out monthly between November 2012 and May 2013, using Van Someren-Rydon traps with bait consisting of mashed banana in fermented sugarcane juice. For each phytophysiognomy, we used 15 traps in pre-defined transects that were revised every 24 h during five days per sampling occasion. After six samplings and 900 trap/day as total effort, 1,127 individuals representing 69 species and 4 subfamilies of fruit-feeding butterflies were recorded. Satyrinae was the most abundant subfamily with the greatest species richness. Considering species abundance, 604 (52.54 % of the individuals) were collected in FES, while 523 (47.46 %) in FOM. The rarefaction showed a significantly greater richness of species in FES which 65 species observed while FOM showed 55. Species accumulation’ curves did not reach the asymptote for each phytophysiognomy. Similarly, the calculated richness analytical estimators Jacknife 1 and Bootstrap showed higher values than the richness sampled in both areas indicating that more species could be observed with an increased sampling effort. Thirty-eight species were new records for the Iguassu National Park. Only one species for each phytophysiognomy was dominant, Memphis moruus stheno (Prittwitz, 1865) in FES and Pareuptychia summandosa (Gosse, 1880) in FOM. The results obtained demonstrate that the fruit-feeding butterflies’ guild of Iguassu National Park has substantial composition and species richness. Furthermore, combined with other local and regional studies, they shall generate information for the conservation and management of reserved areas for biodiversity protection.
Keywords: Lepidoptera, Nymphalidae, conservation, diversity, inventory, species richness, Brazil.
Resumen: Mariposas frugívoras fácilmente capturadas con trampas de cebo, pueden ser usadas en estudios ecológicos comparativos, a través de un protocolo de muestreo. Por lo tanto, el estudio actual compara la agrupación de dos fitofisionomías del Bosque Atlántico del Parque Nacional de Iguazú: Bosque Semicaducifolio (FES) y bosque de Araucaria (FOM) en relación con la abundancia, riqueza y composición de especies. El trabajo de campo fue llevado a cabo mensualmente entre noviembre de 2012 y mayo de 2013, usando trampas Van Someren-Rydon con cebo de plátano aplastado, en jugo de caña de azúcar fermentado. Por cada fitofisionomía, usamos 15 trampas en transectos predefinidos que fueron revisadas cada 24 horas, durante cinco días por cada muestra. Al final de seis muestreos y 900 trampas/día del esfuerzo total, fueron registrados 1.127 individuos representando 69 especies y 4 subfamilias de mariposas frugívoras. Los Satyrinae son la subfamilia más abundante y con la mayor riqueza de especies. Considerando la abundancia de especies, 604 (52.54 % de los individuos) fueron colectados en FES, mientras que 523 (47.46 %) en FOM. El índice de rareza muestra la riqueza de especies significativamente mayor en FES con 65 especies observadas mientras que en FOM se observa 55. Las curvas de acumulación de especies no llegaron a la asíntota para cada fitofiosionomía. De forma similar, el cálculo analítico de la estimación de riqueza Jacknife 1 y Bootstrap, mostraban valores más altos que la abundancia probada en ambas áreas, valores que podrían alcanzarse con un mayor esfuerzo de muestreo. Treinta y ocho especies son nuevos registros para el Parque Nacional de Iguazú. Sólo una especie por cada fitofisionomía fue dominante, siendo Memphis moruus stheno (Prittwitz, 1865) en FES y Pareuptychia summandosa (Gosse, 1880) en FOM. Los resultados obtenidos demuestran que las mariposas frugívoras del Parque Nacional de Iguazú tienen una abundante composición y riqueza de especies. Además, combinando con otros estudios locales y regionales, generarán información para la conservación y protección del medio ambiente y el mantenimiento de áreas reservadas para la protección de la biodiversidad.
Palabras clave: Lepidoptera, Nymphalidae, conservación, diversidad, inventario, riqueza de especies, Brasil.
Introdução
Dentre os diversos grupos de fauna utilizados como principais alicerces para as práticas conservacionistas, as borboletas têm se tornado importantes ferramentas para estudos de biodiversidade (BROWN JR. & FREITAS, 2000a; UEHARA-PRADO et al., 2005, 2007; BONEBRAKE et al., 2010), possuindo ainda um valor particular como indicadores ecológicos (MURPHY, FREAS & WEISS, 1990). Borboletas frugívoras, facilmente capturadas através de armadilhas com isca atrativa (DEVRIES & WALLA, 2001; UEHARA-PRADO et al., 2005), são altamente correlacionadas com a conectividade da paisagem (BROWN JR. & FREITAS, 2000a; HORNER-DEVINE et al., 2003) e riqueza total do ambiente (UEHARA-PRADO et al., 2009). Desta forma, podem ser utilizadas em estudos ecológicos comparativos, seguindo protocolo de amostragem (DEVRIES & WALLA, 2001; RIBEIRO et al., 2008, 2012). Espécies pertencentes a esta guilda são da família Nymphalidae e estão distribuídas em quatro subfamílias: Satyrinae, Charaxinae, Biblidinae e Nymphalinae (tribo Coeini) (WAHLBERG et al., 2009).
O bioma Mata Atlântica inclui paisagens naturais muito complexas ao longo de sua extensão territorial abrangendo variações de clima e relevo, e devido a isso, sua biota é também muito diversificada (GALINDO-LEAL & CÂMARA, 2003; RIBEIRO et al., 2009; FUNDAÇÃO SOS MATA ATLÂNTICA & INPE, 2011). Acredita-se que este bioma abrigue de 1 a 8% de toda biodiversidade mundial (LAGOS & MULLER, 2007), incluindo a maioria das espécies oficialmente ameaçadas de extinção no Brasil (MORELLATO & HADDAD, 2000; TABARELLI et al., 2005). Portanto, devido ao seu alto grau de biodiversidade e endemismo e à elevada taxa de desmatamento, está entre os cinco principais “hotspots” do mundo (MORELATTO & HADDAD, 2000; MYERS et al., 2000; CONSERVAÇÃO INTERNACIONAL, 2013).
O estado atual de conservação das formações florestais da Mata Atlântica brasileira é critico, uma vez que seus remanescentes encontram-se altamente fragmentados (GALINDO-LEAL & CÂMARA, 2003; RIBEIRO et al., 2008, 2012; FUNDAÇÃO SOS MATA ATLÂNTICA & INPE, 2011), apesar do grande número de áreas protegidas (GALINDO-LEAL & CÂMARA, 2003). No estado do Paraná, originalmente coberto em 98% do seu território por esse bioma, hoje restam apenas pouco mais de 10% de florestas naturais bem conservadas. Dentre elas, o Parque Nacional do Iguaçu resguarda o maior remanescente contínuo de Mata Atlântica da região sul do Brasil, com área total de 185.262,5 ha inteiramente contido em uma Unidade de Conservação (UC) de proteção integral (IBAMA, 1999; GALINDO-LEAL & CÂMARA, 2003). Esta UC tem continuidade física no país vizinho, Argentina, no Parque Nacional Iguazú, com 67.620 ha de área, totalizando mais de 252.000 ha de florestas protegidas (IBAMA, 1999; SALAMUNI et al., 2002). Em relação ao tipo de fitofisionomia florestal, dentro do Parque Nacional do Iguaçu encontra-se o maior e melhor conservado fragmento de Floresta Estacional Semidecídua do Paraná. Além desta formação, a porção norte do Parque é ocupada por Floresta Ombrófila Mista, a Floresta de Araucárias, de ocorrência predominante no sul do Brasil, e também sob forte ameaça de extinção (IBAMA, 1999).
Apesar dos estudos pioneiros padronizados na região Neotropical envolvendo borboletas frugívoras datarem dos anos noventa (DEVRIES et al., 1997, 1999), as informações sobre a guilda de borboletas frugívoras na região sul do Brasil eram muitas vezes incompletas em relação às localidades estudadas, períodos de coleta e esforço amostral empregado. Mais recentemente, porém, tem surgido um número crescente de publicações bastante detalhadas (PEDROTTI et al., 2011; SANTOS et al., 2011; BELLAVER et al., 2012; CORSO & HERNÁNDEZ, 2012; SILVA et al., 2013; PAZ et al., 2014), a maioria referente ao estado do Rio Grande do Sul. No estado do Paraná, a fauna frugívora encontra-se ainda sub-representada nos inventários. Os estudos existentes abrangem principalmente a região oeste do Estado, nos municípios de Curitiba e arredores (MIELKE, 1994; BONFFANTI et al., 2011) Guarapuava (DOLIBAINA et al., 2011), o cerrado meridional de Jaguariaíva (CASAGRANDE et al., 2012) e o Parque Estadual de Vila Velha (Ponta Grossa) (MIELKE et al., 2012), constituindo-se todos em inventários da fauna total de borboletas.
No Parque Nacional do Iguaçu, estudos prévios com a fauna de borboletas envolveram a elaboração de uma lista de 257 espécies, pertencentes em sua grande maioria à família Hesperiidae, publicada no Plano de Manejo do Parque (MIELKE, 1968; IBAMA, 1999). Posteriormente, inventários padronizados com uso de rede entomológica e armadilhas atrativas (C. GRACIOTIM, dados não publicados) compilaram as espécies de borboletas ocorrentes na área de turismo e uso público do Parque. Esta região sofreu forte impacto antrópico devido à intensa exploração madeireira antes de se tornar uma UC, e hoje é considerada zona de uso público e visitação das Cataratas do Iguaçu. Assim, o objetivo do presente estudo é aprofundar o conhecimento da fauna de borboletas frugívoras do Parque Nacional do Iguaçu através da realização de inventário em duas fitofisionomias ainda preservadas de Mata Atlântica, a Floresta Estacional Semidecídua e a Floresta Ombrófila Mista, localizadas na zona intangível ao norte do Parque. Além disso, espera-se fornecer subsídios para o conhecimento e conservação dessa fauna através de comparação com outros estudos realizados no Brasil e Argentina, bem como propiciar o acúmulo de informações sobre ecologia e biologia das espécies.
Material e Métodos
ÁREA DE ESTUDO
O Parque Nacional do Iguaçu (Parna do Iguaçu) (Figura 1) está localizado na porção oeste do estado do Paraná (25º 05’ e 25º 40’S e 54º 30’ e 54º 40’W). O clima, segundo a classificação global de Köppen, é do tipo Cfa, caracterizado como temperado subtropical úmido, com estações de inverno e verão bem definidas, onde as chuvas encontram-se distribuídas igualmente ao longo de todo o ano. A temperatura local varia entre 40º C de temperatura máxima e 3º C mínima, tendo como média máxima cerca de 26º C e mínima de 15º C e a pluviosidade média anual é de 1.700 mm, com umidade relativa do ar predominantemente alta, raramente abaixo de 80%, mesmo nos períodos mais secos do ano. A altitude varia de 150 m na porção sul, atingindo 700 m na porção norte do Parque (IBAMA, 1999; SALAMUNI et al., 2002).
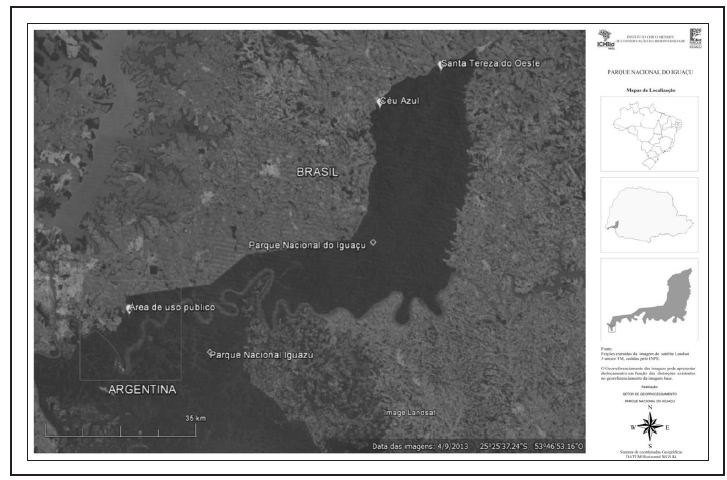
A área do Parque abrange territórios de 14 municípios, com formações florestais heterogêneas e diferindo de acordo com a altitude, solo e clima. A vegetação predominante é a Floresta Estacional Semidecídua, ocorrendo da porção sul até altitudes de 450 m. A partir daí, ocorre a Floresta Ombrófila Mista, cujas árvores maiores atingem alturas de 35 m, sendo comum a presença de troncos com mais de um metro de diâmetro, nas regiões melhor conservadas (IBAMA, 1999).
Foram selecionadas duas áreas amostrais na porção norte do Parque: a primeira no município de Céu Azul (25º 09’ 16,4”S e 53º 50’ 31,5”W), sob domínio da Floresta Estacional Semidecídua (FES), a 400 m de altitude. A segunda, localizada no município de Santa Tereza do Oeste, (25º 04’ 13,1”S e 53º 39’ 32,9”W), abrange o domínio da Floresta Ombrófila Mista (FOM) e se encontra a 650 m de altitude.
AMOSTRAGEM
As armadilhas foram dispostas em um transecto pré-definido para cada área amostral. Em cada uma delas, foram realizadas amostragens mensais com duração de cinco dias, entre novembro de 2012 a maio de 2013, seguindo metodologia padronizada adaptada de UEHARA-PRADO et al. (2005). A escolha do período amostral baseou-se na constatação de que verão e outono são as estações do ano associadas à maior diversidade de borboletas frugívoras (RIBEIRO et al., 2010). Para a captura dos espécimes, utilizaram-se armadilhas do tipo Van Someren-Rydon modificadas (DEVRIES et al., 1997), dispostas linearmente em três unidades amostrais (UAs), distanciadas a cada 100 m. Cada UA era composta por cinco armadilhas instaladas em intervalos de 10 m, totalizando 15 em cada área amostral. As armadilhas foram dispostas em dois níveis de altura do solo, intercaladas em 2 e 8 m aproximadamente, e eram instaladas na parte da manhã do primeiro dia sendo revisadas a cada 24 h para coleta e reposição da isca (HUGHES et al., 1998). A isca constituiu-se de uma mistura de banana amassada com caldo de cana, fermentada por 48 h (DEVRIES et al., 1997).
Uma vez retiradas da armadilha, as borboletas foram identificadas, acondicionadas em envelope entomológico e conduzidas ao laboratório, para posterior montagem e/ou confirmação da identificação com auxílio de bibliografia especializada ou consulta a especialistas. A nomenclatura dos espécimes seguiu LAMAS (2004) e atualizações posteriores, sendo que as categorias supragenéricas foram modificadas segundo WAHLBERG et al. (2009), considerando Brassolini e Morphini como tribos de Satyrinae.
Os indivíduos foram capturados através de licença concedida pelos órgãos reguladores (Ministério do Meio Ambiente / Instituto Chico Mendes de Conservação da Biodiversidade / SISBio). O material testemunho encontra-se depositado na coleção de referência do laboratório de Interações Inseto-Planta da Universidade Federal de Santa Maria, Santa Maria, Rio Grande do Sul, Brasil.
ANÁLISE DE DADOS
Os dados foram analisados a partir dos valores de riqueza (S), abundância (N) e frequência relativa (fr). Para análise da abundância das espécies, foram consideradas “abundantes” aquelas que possuíram as mais altas frequências absolutas, e como “dominantes” as que apresentaram frequência relativa maior que 10% (fr>0,1). Foram construídas curvas de acúmulo de espécies para cada fitofisionomia e calculados estimadores analíticos de riqueza, tendo sido selecionados os que melhor atenderam a representatividade das amostras de acordo com as premissas de: a) estabilidade no desvio padrão independente do tamanho da amostra e b) estabilização com o menor esforço de coleta (MAGURRAN, 2004). Para comparar os valores de riqueza de espécies nas duas fitofisionomias foi realizada uma rarefação baseada em indivíduos, com os respectivos intervalos de confiança a 95%. As análises estatísticas foram realizadas através dos softwares EstimateS 9.1.0. (COLWELL, 2013) e PAST 3.0 (HAMMER et al., 2001).
Para a confirmação de novos registros para o estado do Paraná, foram consultados os trabalhos de CASAGRANDE & MIELKE (1992), MIELKE (1994), DOLIBAINA et al. (2010, 2011), BONFFANTI et al. (2011), CASAGRANDE et al. (2012) e GARCIA-SALIK et al. (2014). Já registros inéditos para o Parna do Iguaçu foram confirmados a partir de consulta a lista constante no Plano de Manejo do Parque Nacional do Iguaçu (IBAMA, 1999).
Os Nymphalinae Colobura dirce dirce (Linnaeus, 1758) e Smyrna blomfildia blomfildia (Fabricius, 1781), atualmente pertencentes a tribo Nymphalini (WARREN, 2013), foram incluídos na lista de espécies por serem considerados frugívoros nos demais trabalhos com o grupo, estando incluídos até recentemente na tribo Coeini (LAMAS, 2004).
Resultados
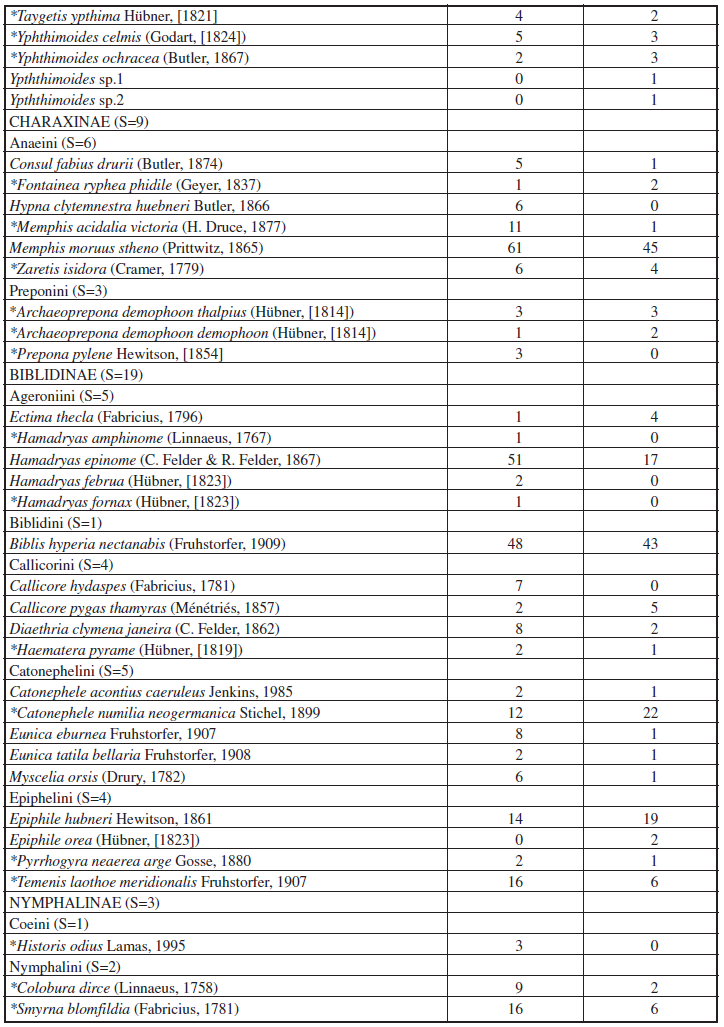
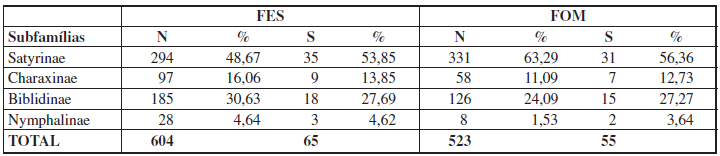
Com um esforço total de 900 armadilhas/dia, foram amostrados 1.127 indivíduos, pertencentes a 69 espécies de borboletas frugívoras, nas duas fitofisionomias florestais do Parque Nacional do Iguaçu (Tabela I). A subfamília com maior abundância foi Satyrinae, com 625 indivíduos, representada por 55,46% do total, seguida por Biblidinae (311 indivíduos; 27,59%), Charaxinae (155 indivíduos; 13,75%) e Nymphalinae (36 indivíduos; 3,19%). A ordem de representatividade da riqueza total foi a mesma, com 38 espécies pertencentes à subfamília Satyrinae (55,07%), 19 a Biblidinae (27,54%), nove a Charaxinae (13,04%) e três a Nymphalinae (4,35%).
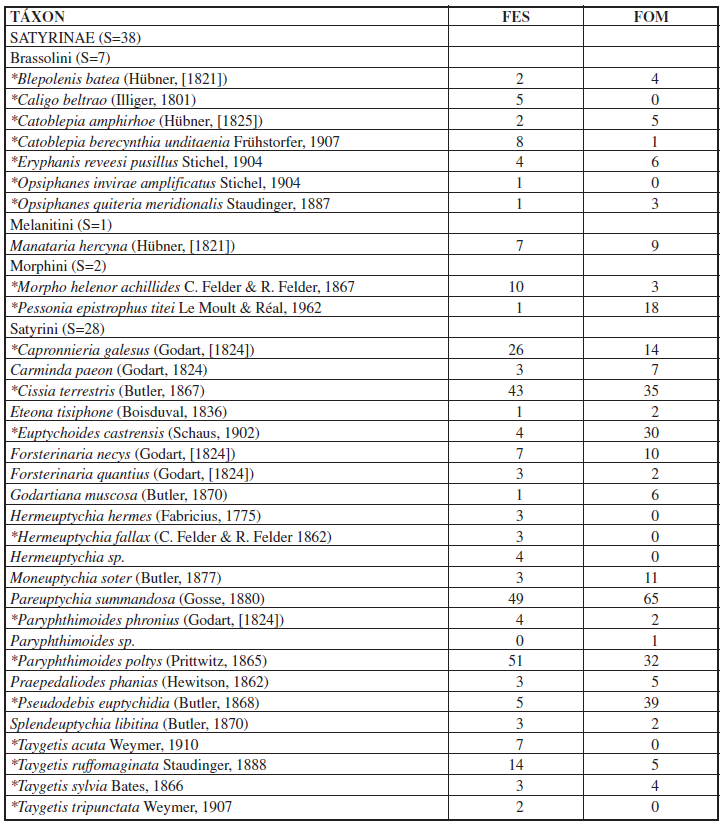
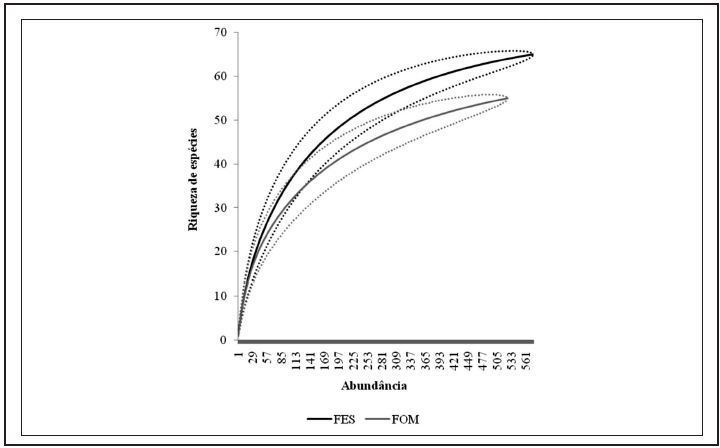
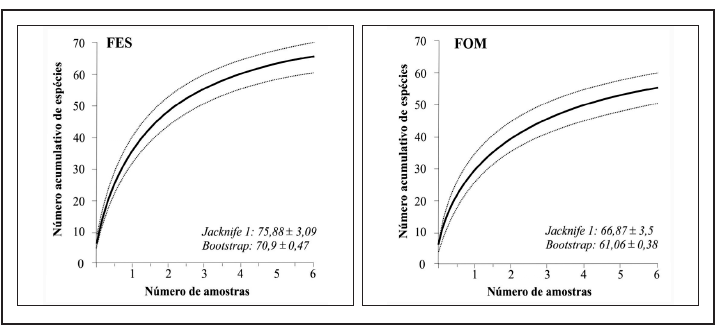
Considerando as duas fitofisionomias florestais amostradas no Parna do Iguaçu, a abundância total e riqueza de espécies apresentaram-se maiores em FES, com 604 indivíduos observados, pertencentes a 65 espécies, enquanto em FOM foram registrados 523 indivíduos de 55 espécies. As representatividades de abundância e riqueza por subfamília seguiram a mesma ordem de grandeza registrada para os valores totais (Tabela II). Os resultados da rarefação (Figura 2) apontam a maior riqueza significativa de espécies em FES. Analisando ainda o padrão de acúmulo de espécies (Figura 3) pode-se observar que as curvas não atingiram a assíntota apresentando-se sempre ascendentes, indicando que uma vez aumentado o esforço amostral mais espécies poderiam ser observadas em ambas as áreas. Da mesma forma, as estimativas do número de espécies de borboletas frugívoras ocorrentes para cada fitofisionomia do Parque, obtidas através dos estimadores analíticos Jacknife1 e Bootstrap apontaram valores maiores do que os amostrados, corroborando as curvas de suficiência amostral obtidas. C. GRACIOTIM & A. B. B. MORAIS 122 SHILAP Revta. lepid., 44 (173) marzo 2016 Tabela II.– Abundância (N) e riqueza de espécies (S) das subfamílias de borboletas frugívoras amostradas nas fitofisionomias florestais do Parque Nacional do Iguaçu, Paraná, Brasil, entre novembro de 2012 e maio de 2013. FES: Floresta Estacional Semidecídua; FOM: Floresta Ombrófila Mista. Os valores de porcentagem (%) referem-se à abundância e riqueza totais por fitofisionomia, respectivamente.
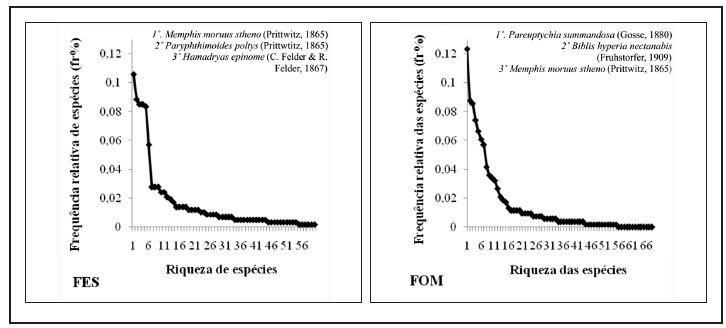
Trinta e oito espécies de borboletas frugívoras constituíram novos registros para o Parque Nacional do Iguaçu, 23 Satyrinae, seis Charaxinae, seis Biblidinae e três Nymphalinae (Tabela I). No total, as três espécies de borboletas mais abundantes foram Pareuptychia summandosa (Gosse, 1880) (Satyrinae), com 114 indivíduos observados, seguida de Memphis moruus stheno (Prittwitz, 1865) (Charaxinae) (N=106) e Biblis hyperia nectanabis (Fruhstorfer, 1909) (Biblidinae) (N=91). Comparando por fitofisionomia, pode-se destacar ainda Hamadryas epinome (C. Felder & R. Felder, 1867) (Biblidinae), Paryphthimoides poltys (Prittwitz, 1865) e Cissia terrestris (Butler, 1867) (Satyrinae) em FES; e Pseudodebis euptychidia (Butler, 1868), C. terrestris e P. poltys em FOM (Tabela I). Considerando as frequências relativas, apenas uma espécie pode ser considerada dominante em relação à abundância total, P. summandosa, e, da mesma forma, ao comparar as distribuições das duas fitofisionomias, somente uma espécie apresentou-se dominante em cada uma delas, respectivamente M. moruus stheno em FES e P. summandosa em FOM (Figura 4).
No total, seis espécies foram representadas por um único indivíduo (“singletons”) e três por dois indivíduos (“doubletons”). Foram elas, respectivamente, os singletons Opsiphanes invirae amplificatus Stichel, 1904, Hamadryas amphinome amphinome (Linnaeus, 1767) e Hamadryas fornax fornax (Hübner, [1823]) em FES; e Paryphthimoides sp., Yphthimoides sp.1 e Yphthimoides sp.2 em FOM. Já Taygetis tripunctata Weymer, 1907 e Hamadryas februa februa (Hübner, [1823]) foram doubletons da FES, e apenas Epiphile orea orea (Hübner, [1823]) em FOM (Tabela I).
Discussão
A riqueza total de borboletas frugívoras encontrada no Parna do Iguaçu foi maior do que aquelas registradas em outros inventários feitos exclusivamente com armadilhas, em fragmentos de Mata Atlântica do sul e sudeste do Brasil, desconsiderando algumas diferenças em relação a esforço amostral e tipos de fitofisionomia (PEDROTTI et al., 2011, com 30 espécies; CORSO & HERNÁNDEZ, 2012, com 20; SILVA et al., 2013, com 16; PAZ et al., 2014, com 44). Porém, ela foi menor do que registrado por SANTOS et al. (2011), com 76 espécies, e UEHARA-PRADO et al. (2004), com 83. Estudos realizados em áreas de conservação próximas ao Parque, situadas em território argentino, também registraram maiores valores de riqueza (NÚÑEZ-BUSTOS, 2008, com 93; NÚÑEZ-BUSTOS, 2009, com 99), observando, no entanto que os mesmos resultaram de períodos amostrais bem maiores e com uso de outros métodos de coleta, além de revisões bibliográficas e de coleções entomológicas (NÚÑEZ-BUSTOS, 2009).
Os maiores valores de riqueza e abundância de Satyrinae no total e por fitofisionomia também foram registrados em estudos realizados e sul e sudeste da Mata Atlântica do Brasil (PEDROTTI et al., 2011; SANTOS et al., 2011; UEHARA-PRADO et al., 2004; PAZ et al., 2014) e Argentina (NÚÑEZBUSTOS, 2008, 2009). Esses resultados corroborariam as observações de DEVRIES (1987) de que a grande diversidade de hábitats dos neotrópicos tornaria essa região a maior em riqueza de Satyrinae no mundo, sendo este considerado o maior grupo dentro de Nymphalidae (LAMAS, 2004).
A maior abundância registrada em FES pode ser atribuída em grande parte ao maior número de indivíduos registrado nas espécies mais abundantes nessa fitofisionomia, respectivamente M. moruus stheno, P. poltys e B. hyperia nectanabis. Por outro lado, condições climáticas desfavoráveis a atividade de insetos como temperaturas mais baixas, vento e pluviosidade foram registradas em alguns dias da amostragem em FOM, o que pode ter contribuído para a menor abundância dessa área amostral. M. moruus stheno é uma espécie exclusivamente neotropical e presente no sul do Brasil. Essa espécie possui variação morfológica complexa devido a dimorfismo sexual e sazonal, utilizando espécies de Lauraceae como planta hospedeira, como Ocotea nutans (Nees) Mez e Nectandra grandiflora Ness (DIAS et al., 2010), presentes na área de estudo. Já P. summandosa é uma espécie de tamanho pequeno, cujos juvenis são geralmente associados a gramíneas (Poaceae) (DEVRIES, 1987). B. hyperia nectanabis e H. epinome são espécies consideradas comuns e abundantes estando normalmente associadas a habitats de clareiras, bordas de mata e ambientes perturbados (DEVRIES, 1987; MORAIS et al., 2007; UEHARA-PRADO et al., 2007; SACKIS & MORAIS, 2008).
Euptychoides castrensis (Schaus, 1902) (Satyrinae) merece destaque na FOM, pois teve abundância de 30 indivíduos observados, enquanto na FES apenas quatro foram amostrados. Segundo PEDROTTI et al. (2011) essa seria uma espécie associada e muito abundante em ambientes de Floresta Ombrófila Mista no Estado do Rio Grande do Sul. No estado do Paraná, apenas DOLIBAINA et al. (2011) registraram anteriormente a ocorrência da espécie, também em Floresta Ombrófila Mista no município de Guarapuava e arredores.
Em relação à composição de espécies, a maioria daquelas consideradas como novo registro para o Parna do Iguaçu já havia sido observada em estudos anteriores realizados no mesmo (C. GRACIOTIM, dados não publicados) assim como nas áreas de conservação vizinhas da Argentina (NÚÑEZ-BUSTOS, 2008, 2009), corroborando uma possível continuidade de habitat para essas borboletas. Além disso, de todas elas, apenas Caligo beltrao (Illiger, 1801) e Hermeuptychia fallax (C. Felder & R. Felder, 1862) não haviam sido previamente amostradas no estado do Paraná por DOLIBAINA et al. (2011) em regiões de Floresta Ombrófila Mista, Campos Naturais e Floresta Estacional Semidecidual.
Comparando a composição das assembléias entre as fitofisionomias, além das espécies “singletons” e “doubletons”, todas aquelas que foram amostradas exclusivamente em FES ou FOM podem ser consideradas raras, pois tiveram abundância menor que 10 indivíduos. Segundo BROWN JR. & FREITAS (1999), muitas dessas espécies aparentemente raras seriam muito difíceis de encontrar em qualquer lugar ou época do ano, até mesmo quando presentes, uma vez que se mantêm em populações pequenas, sazonais e erráticas, possivelmente associadas à maior complexidade estrutural das comunidades (HALFFTER & MORENO, 2005). Uma vez intensificada a amostragem na escala temporal, a riqueza total registrada tende a aumentar, assim como também a probabilidade de detecção de espécies com tamanhos populacionais pequenos (SUMMERVILLE et al., 2001).
Finalmente, considerando o papel de indicador ecológico atribuído a algumas espécies de borboletas frugívoras, é importante mencionar a presença no Parna do Iguaçu de C. beltrao, Manataria hercyna hercyna (Hübner, [1821]), Taygetis acuta Weymer, 1910, e H. fornax fornax (cujo único indivíduo amostrado foi coletado em armadilha em dossel). C. beltrao é citada por NÚÑEZ-BUSTOS (2008) como bastante local na Reserva Privada de Yacutinga (Província de Misiones, Argentina), e de acordo com o mesmo autor poderia estar associada ao estado de conservação da Reserva, pois seus indivíduos não seriam encontrados com facilidade fora da mesma. Por sua vez, M. hercyna hercyna, T. acuta e H. fornax fornax foram destacadas por BROWN JR. & FREITAS (2000b) como indicadoras de ambiente rico e preservado de Mata Atlântica.
Muito embora a maioria das espécies oficialmente ameaçadas de extinção no país habite o bioma Mata Atlântica, a flora e fauna desse bioma ainda são pouco conhecidas (FUNDAÇÃO SOS MATA ATLÂNTICA & INPE, 2010). Este importante fragmento florestal que é o Parque Nacional do Iguaçu pode servir de refúgio e abrigo para diversas espécies de fauna, incluindo uma expressiva riqueza de borboletas frugívoras, conforme registrado no presente estudo. A continuação dos estudos com a fauna de borboletas do Parque poderá aumentar o conhecimento sobre a biologia, ecologia e conservação dessas espécies. Além disso, aliados aos demais estudos locais e regionais, os resultados obtidos podem gerar informações para a conservação e manejo de áreas reservadas para a proteção de biodiversidade.
Agradecimientos
As autoras agradecem aos doutores O. H. H. Mielke e M. M. Casagrande (UFPR), por permitirem a visita à coleção científica Pe. Jesus Santiago Moure. Ao ICMBio/SISBio pela concessão de licença de coleta (N. 35291) e ao Parque Nacional do Iguaçu e colaboradores pelo apoio logístico.
BIBLIOGRAFIA
BELLAVER, J. M., ISERHARD, C. A., SANTOS, J. P., SILVA, A. K., TORRES, M., SIEWERT, R. R., MOSER,A. & ROMANOWSKI, H. P., 2012.– Butterflies (Lepidoptera: Papilionoidea and Hesperioidea) from Swamp forests and Restinga forests at the southern Brazilian Coastal Plain.– Biota Neotropica, 12(4): 181-190.
BONEBRAKE, T. C., PONISIO, L. C., BOGGS, C. L. & EHRLICH, P. R., 2010.– More than just indicators: a review of tropical butterfly ecology and conservation.– Biological Conservation, 143: 1831 1841.
BONFANTTI, D., LEITE, L. A. R., CARLOS, M. M., CASAGRANDE, M. M., MIELKE, E. C. & MIELKE, O. H.H, 2011.– Riqueza de borboletas em dois parques urbanos de Curitiba, Paraná, Brasil.– Biota Neotropica, 11(2): 247-253.
BROWN JR., K. S. & FREITAS, A. V. L., 1999.– Lepidoptera.– In C. R. F, BRANDÃO & E. M. CANCELLO. Biodiversidade do Estado de São Paulo, Brasil: síntese do conhecimento ao final do século XX, 5: invertebrados terrestres: p. 227-243. FAPESP, São Paulo.
BROWN JR., K. S. & FREITAS, A. V. L., 2000a.– Atlantic Forest butterflies: indicators for landscape conservation.– Biotropica, 32(4b): 934-956.
BROWN JR., K. S. & FREITAS, A. V. L., 2000b.– Diversidade de Lepidoptera em Santa Teresa, Espírito Santo.– Boletim Museu Biológico Mello Leitão (N. Série), 11/12: 71-118.
CASAGRANDE, M. M. & MIELKE, O. H. H., 1992.– Borboletas (Lepidoptera) ameaçadas de extinção no Paraná.– Revista Brasileira de Zoologia, 9: 75-92.
CASAGRANDE, M. M., DOLIBAINA, D. R., CARNEIRO, E., DIAS, F. M. S., LEITE, L. A. R. & MIELKE, O.H. H., 2012.– Borboletas (Hesperioidea e Papilionoidea) de Jaguariaíva, Paraná, Brasil: Inventário em um enclave de cerrado meridional.– In O. T. B CARPANEZZI & J. B. CAMPOS. Coletânea de Pesquisas. Parques estaduais Vila Velha, Cerrado e Guartelá: 295-308, IAP, Curitiba.
COLWELL, R. K., 2007.– Estimates 9.0: Statistical estimation of species richness and shared species from samples. University of Connecticut, USA. Disponível em http://purl.oclc.org/estimates (acesso em 23 de janeiro de 2013).
CONSERVAÇÃO INTERNACIONAL, 2013.– Prioridade de Conservação. Hostspots. Disponível em: http://www.conservation.org.br/como/index.php?id=8 (acesso em 6 de agosto de 2013).
CORSO, G. & HERNÁNDEZ, M. M., 2012.– Borboletas frugívoras da Mata Atlântica no Parque Estadual da Serra do Tabuleiro, Santa Catarina, Brasil.– Biotemas, 25(4): 139-148.
DEVRIES, P. J., 1987.– The butterflies of Costa Rica and their natural history. Papilionidae, Pieridae, Nymphalidae: 327 pp. Princeton University Press, New Jersey.
DEVRIES, P. J., MURRAY, D. & LANDE, R., 1997.– Species diversity in vertical, horizontal, and temporal dimensions of a fruit-feeding butterfly community in an Ecuadorian rainforest.– Biological Journal of the Linnean Society, 62: 343-364.
DEVRIES, P. J., WALLA, T. R. & GRENNEY, H. F., 1999.– Species diversity in spatial and temporal dimensions of fruit-feeding butterflies from two Ecuadorian rainforests.– Biological Journal of the Linnean Society, 68(3): 333-353.
DEVRIES, P. J. & WALLA, T. R., 2001.– Species diversity and community structure in Neotropical fruit-feeding butterflies.– Biological Journal of the Linnean Society, 74: 1-15.
DIAS, F. M. S., CASAGRANDE M. M. & MIELKE, O. H. H., 2010.– Aspectos biológicos e morfologia externa dos imaturos de Memphis moruus stheno (Prittwitz) (Lepidoptera: Nymphalidae).– Neotropical Entomology, 39(3): 400-413.
DOLIBAINA, D. R., CARNEIRO, E., DIAS, F. M. S. & MIELKE, O. H. H., 2010.– Registros inéditos de borboletas (Papilionoidea e Hesperioidea) ameaçadas de extinção para o Estado do Paraná, Brasil: novos subsídios para a reavaliação dos critérios de ameaça.– Biota Neotropica, 10(3): 75-81.
DOLIBAINA, D. R., MIELKE, O. H. H. & CASAGRANDE, M. M., 2011.– Borboletas (Papilionoidea e Hesperioidea) de Guarapuava e arredores, Paraná, Brasil: um inventário com base em 63 anos de registros.– Biota Neotropica, 11(1): 341-354.
FUNDAÇÃO SOS MATA ATLÂNTICA & INPE (Instituto Nacional de Pesquisas Espaciais), 2011.– Atlas dos remanescentes florestais da Mata Atlântica período: 2008-2010: 60 pp. Fundação SOS Mata Atlântica/INPE, São Paulo.
GALINDO-LEAL, C. & CÂMARA, I. G. 2003.– Atlantic forest hotspots status: an overview. In C. GALINDOLEAL & I.G. CÂMARA (eds.).The Atlantic Forest of South America: biodiversity status, threats, and outlook: p. 3-11. Center for Applied Biodiversity Science and Island Press, Washington, D.C.
GARCIA-SALIK, L. M., CARNEIRO, E., DOLIBAINA, D. R., DIAS, F. M. S., RIBEIRO-LEITE, L. A., CASAGRANDE, M. M. & MIELKE, O. H. H. 2014.– Borboletas da Estação Ecológica do Caiuá, Diamante do Norte, Paraná, Brasil (Lepidoptera: Hesperioidea & Papilionoidea).– SHILAP Revista de lepidopterología, 42(166): 265-280.
HALFFTER, G. & MORENO, C. E., 2005.– Significado biológico de las diversidades alfa, beta y gamma.– In G. HALFFTER, J. SOBERÓN, P. KOLEFF & A. MELIC. Sobre diversidad biológica: el significado de las diversidades alfa, beta y gamma.– Monografías Tercer Milenio, 4: 5 18. Sociedad Entomológica Aragonesa, Zaragoza.
HAMMER, Ø, HARPER, D. A. T. & RYAN, P. D., 2001.– PAST: Paleontological Statistics software package for education and data analysis.– Palaeontologia Electronica, 4(1): 1-9.
HORNER-DEVINE, M. C., DAILY, G. C., EHRLICH, P. R. & BOGGS, C. L., 2003.– Countryside biogeography of tropical butterflies.– Conservation Biology, 17: 168-177.
HUGHES, J. B., DAILY, G. C. & EHRLICH, P. R., 1998.– Use of bait traps for monitoring of butterflies (Lepidoptera: Nymphalidae).– Revista de Biología Tropical, 46(3): 697-704.
IBAMA, 1999.– Plano de Manejo do Parque Nacional do Iguaçu: 294 pp.
LAGOS, A. R. & MULLER, B. L. A., 2007.– Hotspot brasileiro: Mata Atlântica.– Saúde e Ambiente em Revista, 2(2): 35-45.
LAMAS, G., 2004.– Checklist: Part 4A. Hesperioidea-Papilionoidea.– In J. B. HEPPNER. Atlas of Neotropical Lepidoptera: 439 pp. Association for Tropical Lepidoptera/Scientific Publishers, Gainesville.
MAGURRAN, A. E., 2004.– Measuring biological diversity: 215 pp. Blackwell Science Ltda, Malden, Oxfrod, Victoria.
MIELKE, C. G. C., 1994.– Papilionoidea e Hesperioidea (Lepidoptera) de Curitiba e seus arredores, Paraná, Brasil, com notas taxonômicas sobre Hesperiidae.– Revista Brasileira de Zoologia, 11: 759-776.
MIELKE, O. H. H., 1968.– Contribuição ao estudo faunístico dos “Hesperiidae” brasileiros I. Resultados de uma excursão a Foz do Iguaçu, Paraná, Brasil, com notas taxonômicas (Lepidoptera).– Atas da Sociedade de Biologia do Rio de Janeiro, 12(2): 73-78.
MIELKE, O. H. H., CARNEIRO, E. & CASAGRANDE, M. M., 2012.– Hesperiidae (Lepidoptera, Hesperioidea) from Ponta Grossa, Paraná, Brazil: 70 years of records with special reference to faunal composition of Vila Velha State Park.– Revista Brasileira de Entomologia, 56(1): 59-66.
MORAIS, A. B., ROMANOWSKI, H. P., ISERHARD, C. A., MARCHIORI, M. O. & SEGUI, R., 2007.– Mariposas del sur de Sudamérica (Lepidoptera: Papilionoidea e Hesperioidea).– Ciência e Ambiente, 35: 29- 46.
MORELLATO, L. P. C. & HADDAD, C. F. B., 2000.– Introduction: the Brazilian Atlantic Forest.– Biotropica, 32: 786-792.
MURPHY, D. D., FREAS, K. E. & WEISS, S. B., 1990.– An environment-metapopulation approach to population viability analysis for a threatened invertebrate.– Conservation Biology, 4: 41-51.
MYERS, N., MITTERMEIER, R. A., MITTERMEIER, C. G., FONSECA, G. A. B. & KENT, J., 2000.– Biodiversity hotspots for conservation priorities.– Nature, 403: 845-853.
NÚÑEZ-BUSTOS, E. O., 2008.– Diversidad de mariposas diurnas en la Reserva Privada Yacutinga, Provincia de Misiones, Argentina (Lepidoptera: Hesperioidea y Papilionoidea).– Tropical Lepidoptera Research, 18(2): 78-87.
NÚÑEZ-BUSTOS, E. O., 2009.– Mariposas diurnas (Lepidoptera: Papilionoidea y Hesperioidea) del Parque Nacional Iguazú, Provincia de Misiones, Argentina).– Tropical Lepidoptera Research, 19(2): 71-81.
PAZ, A. L. G., ROMANOWSKI, H. P. & MORAIS, A. B. B., 2014 - Borboletas frugívoras do centro oeste do Rio Grande do Sul, Brasil (Lepidoptera: Nymphalidae).– SHILAP Revista de lepidopterología, 42(167):409-422.
PEDROTTI, V. S., BARROS, M. P., ROMANOWSKI, H. P. & ISERHARD, C., 2011.– Borboletas frugívoras (Lepidoptera: Nymphalidae) ocorrentes em um fragmento de Floresta Ombrófila Mista no Rio Grande do Sul, Brasil.– Biota Neotropica, 11(1): 385-390.
RIBEIRO, D. B., PRADO, P. I., BROWN JR., K. S. & FREITAS, A. V. L., 2008.– Additive partitioning of butterfly diversity in a fragmented landscape: importance of scale and implications for conservation.– Diversity and Distributions, 14(6): 961-968.
RIBEIRO, M. C., METZGER, J. P., MARTENSEN, A. C., PONZONI, F. J. & HIROTA, M. M., 2009.– The Brazilian Atlantic Forest: How much is left, and how is the remaining forest distributed? Implications for conservation.– Biological Conservation, 142: 1141-1153.
RIBEIRO, D. B., PRADO, P. I., BROWN JR., K. S. & FREITAS, A. V. L., 2010.– Temporal diversity patterns and phenology in fruit-feeding butterflies in the Atlantic forest.– Biotropica, 42(6): 710-716.
RIBEIRO, D. B., BATISTA, R., PRADO, P. I., BROWN JR., K. S. & FREITAS, A. V. L., 2012.– The importance of small scales to fruit-feeding butterfly assemblages in a fragmented landscape.– Biodiversity and Conservation, 21(3): 811-827.
SACKIS, G. D. & MORAIS, A. B. B., 2008.– Borboletas (Lepidoptera: Hesperioidea e Papilionoidea) do campus da Universidade Federal de Santa Maria, Santa Maria, Rio Grande do Sul.– Biota Neotropica, 8(1): 151-158.
SALAMUNI, R., SALAMUNI, E., ROCHA, L. A. & ROCHA, A. L., 2002.– Parque Nacional do Iguaçu, PR - Cataratas de fama mundial.– In C. SCHOBBENHAUS, D. A. CAMPOS, E. T. QUEIROZ, M. WINGE & M.BERBERT-BORN. Sítios Geológicos e Paleontológicos do Brasil, 1: 313-321. DNPM/CPRM – Comissão Brasileira de Sítios Geológicos e Paeleontológicos (SIGEP), Brasília.
SANTOS, J. P., ISERHARD, C. A., TEIXEIRA, M. O. & ROMANOWSKI, H. P., 2011.– Fruit-feeding butterflies guide of subtropical Atlantic Forest and Araucaria Moist Forest in State of Rio Grande do Sul, Brazil.– Biota Neotropica, 11(3): 253-274.
SILVA, J. M., CUNHA, S. K, da, SILVA, E. J. E. & GARCIA, F. R. M., 2013.– Borboletas frugívoras (Lepidoptera: Nymphalidae) no Horto Botânico Irmão Teodoro Luis, Capão do Leão, Rio Grande do Sul, Brasil.– Revista Biotemas, 26(1): 87-96.
SUMMERVILLE, K. S., METZLER, E. H. & CRIST, T. O., 2001.– Diversity of Lepidoptera in Ohio forests at local and regional scales: how heterogeneous is the fauna?.– Annals of the Entomological Society of America, 94(4): 583-591.
TABARELLI, M., PINTO, L. P., SILVA, J. M. C., HIROTA, M. M. & BEDÊ, L. C., 2005.– Desafios e oportunidades para a conservação da biodiversidade na Mata Atlântica Brasileira.– Megadiversidade, 1(1): 132-138.
UEHARA-PRADO, M., FREITAS, A. V. L., FRANCINI, R. B. & BROWN JR., K. S., 2004.– Guia das borboletas frugívoras da Reserva Estadual do Morro Grande e região de Caucaia do Alto, Cotia (São Paulo).– Biota Neotropica, 4(1): 1-25.
UEHARA-PRADO, M., BROWN JR., K. S. & FREITAS, A. V. L., 2005.– Biological traits of frugivorous butterflies in a fragmented and a continuous landscape in the South Brazilian Atlantic Forest.– Journal of Lepidoptera Society, 59(2): 96-106.
UEHARA-PRADO, M., BROWN JR., K. S. & FREITAS, A. V. L., 2007.– Species richness, composition and abundance of fruit-feeding butterflies in the Brazilian Atlantic Forest: comparison between a fragmented and a continuous landscape.– Global Ecology and Biogeography, 16(1): 43-54.
UEHARA-PRADO, M., FERNANDES, J. O., BELLO, A. M., MACHADO, G., SANTOS, A. J., VAZ-DE-MELO, F. Z. & FREITAS, A. V. L., 2009.– Selecting terrestrial arthropods as indicators of small-scale disturbance: A first approach in the Brazilian Atlantic Forest.– Biology Conservation, 142(6): 1220-1228.
WAHLBERG, N., LENEVEU, J., KODANDARAMAIAH, U., PEÑA, C., NYLIN, S., FREITAS, A. V. L. & BROWER, A. V. Z., 2009.– Nymphalid butterflies diversity following near demise at the Cretaceous/Tertiary boundary.– Proceedings of the Royal Society B, 276(1677): 4295-4302.
WARREN, A. D., DAVIS, K. J., STANGELAND, E. M., PELHAM, J. P. & GRISHIN, N. V., 2013.– Illustrated Lists of American Butterflies.– Available from http://www.butterfliesofamerica.com/ (acesso em 14 de Janeiro de 2014).
Notas de autor
kamilagraciotim@hotmail.com